
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
一、热化学方程式的书写
与普通化学方程式相比,书写热化学方程式除了遵循书写普通化学方程式外,还应该注意以下几点:
①反应热ΔH与测定的条件(温度、压强)有关,因此书写热化学方程式时应注明应热ΔH的测定条件。若没有注明,就默认为是在25℃、101KPa条件下测定的。
②反应热ΔH只能写在标有反应物和生成物状态的化学方程式的右边。ΔH为“-”表示放热反应,ΔH为“+”表示吸热反应。ΔH的单位一般为kJ·mol-1(kJ/mol)。
③反应物和生成物的聚集状态不同,反应热ΔH不同。因此热化学方程式必须注明物质的聚集状态固体用“s”、液体用“l”、气体用“g”、溶液用“aq”等表示,只有这样才能完整地体现出热化学方程式的意义。热化学方程式中不标“↑”或“↓”。
④热化学方程式中各物质化学式前面的化学计量数仅表示该物质的物质的量,不表示物质的分子数或原子数,因此化学计量数可以是整数,也可以是分数。
⑤热化学方程式是表示反应已完成的数量。由于ΔH与反应完成物质的量有关,所以方程式中化学前面的化学计量系数必须与ΔH相对应,如果化学计量系数加倍,那么ΔH也加倍。当反应逆向进行时,其反应热与正反应的反应热数值相等,符号相反。
⑥在稀溶液中,酸跟碱发生中和反应生成1 mol 水时的反应热叫中和热。书写中和热的化学方程式应以生成1 mol 水为基准。
⑦反应热可分为多种,如燃烧热、中和热、溶解热等,在101KPa时,1 mol 纯物质完全燃烧生成稳定的氧化物时所放出的热量,叫做该物质的燃烧热。
【例题1】25℃、101 KPa下,碳、氢气、甲烷和葡萄糖的燃烧热依次是393.5 kJ/mol、285.8 kJ/mol、890.3 kJ/mol、2800 kJ/mol,则下列热化学方程式正确的是:
A.C(s)+1/2O2(g)==CO(g);ΔH =-393.5 kJ/mol
B.2H2(g)+O2(g)==2H2O(g);ΔH =+ 571.6 kJ/mol
C.CH4(g) + 2O2(g)== CO2(g) + 2H2O(g);ΔH =-890.3 kJ/mol
D.1/2C6H12O6(s) + 3O2(g) === 3CO2(g) + 3H2O(1);ΔH =-1400 kJ/mol
解析:燃烧热是指在101 KPa时,1mol 物质完全燃烧生成稳定的氧化物时放出的热量。对C而言稳定的氧化物指CO2(g)、对H2而言稳定的氧化物指H2O(l)。所以A、B、C错误,正确答案为D。
答案:D
【例题2】 已知充分燃烧a g 乙炔气体时生成1 mol 二氧化碳气体和液态水,并放出热量b kJ,则乙炔燃烧的热化学方程式正确的是:
A.2C2H2(g) + 5O2(g) === 4CO2(g) + 2H2O(l)ΔH = -4b K J/mol
B.C2H2(g) + 5/2O2(g) ===2CO2(g) + H2O(l) ΔH =2b K J/mol
C.2C2H2(g) + 5O2(g)=== 4CO2(g) + 2H2O(l) ΔH = -2b K J/mol
D.2C2H2(g) + 5O2(g)=== 4CO2(g) + 2H2O(l) ΔH =b K J/mol
解析:放热反应中ΔH<0,所以B、D错误。生成1 mol CO2时放出b kJ的热量,所以,生成4 mol CO2时放出热量为4b kJ,所以A正确。
答案:A
【例题3】(09四川卷9)25 ℃,101 K Pa时,强酸与强碱的稀溶液发生中和反应的中和热为57.3kJ/mol,辛烷的燃烧热为5518 kJ/mol。
下列热化学方程式书写正确的是
A.2H+(aq) + SO42-(aq) + Ba2+(aq) +2OH-(aq)=BaSO4(s) +2H2O(1) ΔH=-57.3 kJ/mol
B.KOH(aq) + 1/2H2 SO4(aq)=1/2K2SO4(aq) + H2O(l) ΔH=-57.3kJ/mol
C.C8H18(l) + 25/2O2(g)=8CO2(g)+ 9H2O ΔH=-5518 kJ/mol
D.2C8H18(g) + 25O2(g)=16CO2(g)+18H2O(1) ΔH=-5518 kJ/mol
答案:B
点拨:书写表示燃烧热的化学方程式时,可燃物的化学计量系数为1;产物应为完全燃烧生成的稳定氧化物,如C燃烧产物为CO2而不是CO,H2燃烧生成的是H2O(l),而不是H2O(g)。书写表示中和热的热化学方程式时,H2O的化学计量系数为1,并以此配平其余物质的化学计量系数。
二、热化学方程式的计算
①根据能量:ΔH =E总(生成物)-E总(反应物)
②根据键能:ΔH =E总(断键)-E总(成键)
③燃烧热:Q(放) =n(可燃物)·ΔH(燃烧热)
④中和热:Q(放) =n(H2O )·ΔH(中和热)
⑤将ΔH看作是热化学方程式中的一项,再按普通化学方程式的计算步骤、格式进行计算,得出有关数据。
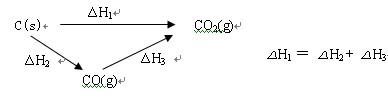
⑥如果一个反应可以分几步进行,则各分步反应的反应热之和与该反应一步完成时的反应热是相同的,即盖斯定律:化学反应的反应热只与反应的始态(各反应物)和终态(各生成物)有关,而与反应的途径无关。如:
【例题4】已知:①1 mol H2分子中化学键断裂时需要吸收436 kJ的能量,②1mol Cl2分子中化学键断裂时需要吸收243kJ的能量,③由H原子和Cl 原子形成1mol HCl分子时释放431kJ的能量。下列叙述正确的是
A.氢气和氯气反应生成氯化氢气体的热化学方程式是H2(g) + Cl2(g) =2HCl(g)
B.氢气和氯气反应生成2 mol 氯化氢气体,反应的ΔH =183 kJ/mol
C.氢气和氯气反应生成2 mol 氯化氢气体,反应的ΔH = -183 kJ/mol
D.氢气和氯气反应生成1 mol 氯化氢气体,反应的ΔH = -183 kJ/mol
解析:根据热化学方程式的书写原则和反应热的计算方法:ΔH =反应物键能总和-生成物键能总和,即ΔH =436 kJ/mol + 243 kJ/mol -2×431 kJ/mol = -183 kJ/mol,因此正确的热化学方程式是:H2(g) + Cl 2(g) =2HCl(g) ΔH = -183 kJ/mol。故选C。
点拨:热化学方程式中的ΔH必须标明“+”或“-”符号,比较反应热(ΔH)的大小时,要注意带符号(“+”或“-”)进行比较。热化学方程式中的反应热数值表示反应物按方程式中化学计量数反应进行到底时的热量值,如反应是可逆反应,则热量值小于对应的反应热数值。化学反应逆向进行时,其反应热的数值不变,但符号改变。
【例题5】(09宁夏卷![]() 28)(14分)2SO2(g) + O2(g) =2SO3(g) 反应过程的能量变化如图所示。已知1 mol SO2(g)氧化为1 mol SO3的ΔH=-99kJ·mol-1.请回答下列问题:
28)(14分)2SO2(g) + O2(g) =2SO3(g) 反应过程的能量变化如图所示。已知1 mol SO2(g)氧化为1 mol SO3的ΔH=-99kJ·mol-1.请回答下列问题:
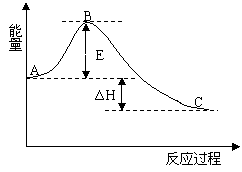
![]() (1)图中A、C分别表示______ 、______ ,E的大小对该反应的反应热有无影响?______ 。该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低?_____,理由是 ______;
(1)图中A、C分别表示______ 、______ ,E的大小对该反应的反应热有无影响?______ 。该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低?_____,理由是 ______;
![]() (2)图中ΔH =______ kJ·mol-1;
(2)图中ΔH =______ kJ·mol-1;
![]() (3)V2O5的催化循环机理可能为:V2O5氧化SO2时,自身被还原为四价钒化合物;四价钒化合物再被氧气氧化。写出该催化循环机理的化学方程式__________________ ;
(3)V2O5的催化循环机理可能为:V2O5氧化SO2时,自身被还原为四价钒化合物;四价钒化合物再被氧气氧化。写出该催化循环机理的化学方程式__________________ ;
![]() (4)如果反应速率υ(SO2)为0.05 mol·L-1·min-1,则υ(O2)=______mol·L-1·min-1、υ(SO3) =______mol·L-1·min-1;
(4)如果反应速率υ(SO2)为0.05 mol·L-1·min-1,则υ(O2)=______mol·L-1·min-1、υ(SO3) =______mol·L-1·min-1;
![]() (5)已知单质硫的燃烧热为296 kJ·mo l-1,计算由S(s)生成3 mol SO3(g)的ΔH=______(要求计算过程)。
(5)已知单质硫的燃烧热为296 kJ·mo l-1,计算由S(s)生成3 mol SO3(g)的ΔH=______(要求计算过程)。
![]()
![]() 解析:(1)本小题考查反应物总能量高于生成物总能量为放热反应,可得到a和C所表示的意义,E为活化能与反应热无关,但是用催化剂可以降低活化能;
解析:(1)本小题考查反应物总能量高于生成物总能量为放热反应,可得到a和C所表示的意义,E为活化能与反应热无关,但是用催化剂可以降低活化能;
(2)图中表示的是2mol SO2的反应,因此ΔH=-99×2kJ·mol-1;
(3)依题意即可写出:SO2+V2O5 =SO3+2VO2;4VO2 + O2=2V2O5;
(4)依据速率之比等于化学计量数之比
![]() 答案:(1)反应物能量 生成物能量 (2)无 降低 因为催化剂改变了反应的历程使活化能E降低 (3)-198 (4) SO2+V2O5 =SO3 +2VO2 4VO2 + O2 =2V2O5 (4)0·025 0.05
答案:(1)反应物能量 生成物能量 (2)无 降低 因为催化剂改变了反应的历程使活化能E降低 (3)-198 (4) SO2+V2O5 =SO3 +2VO2 4VO2 + O2 =2V2O5 (4)0·025 0.05 ![]() (5))S(s) + O2(g) =2SO2(g) ΔH1=-296 kJ·mol-1, SO2(g)+1/2O2(g) =SO3(g) ΔH2=-99 kJ·mol-1
(5))S(s) + O2(g) =2SO2(g) ΔH1=-296 kJ·mol-1, SO2(g)+1/2O2(g) =SO3(g) ΔH2=-99 kJ·mol-1![]() 3S(s) + 9/2O2(g) =3SO3(g) ΔH =3(ΔH1+ΔH2)=-1185 kJ·mol-1
3S(s) + 9/2O2(g) =3SO3(g) ΔH =3(ΔH1+ΔH2)=-1185 kJ·mol-1
【例题6】(2008年·全国Ⅱ)红磷p(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g),反应过程和能量关系如图所示(图中的ΔH表示生成1mol 产物的数据)
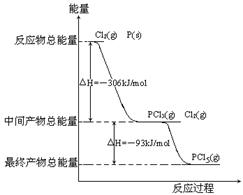
根据上图回答下列问题
(1)P和Cl2反应生成PCl3的热化学方程式______ ;
(2)PCl5分解生成PCl3和Cl2的热化学方程式______ ;上述分解反应是一个可逆反应,温度T1时,在密闭容器中加入0.80 mol PCl5,反应达到平衡时还剩余0.60 mol PCl5,其分解率α1等于______ ;若反应温度由T1升高到T2,平衡时PCl5分解率α2,α2______ α1(填“大于”,“小于”或“等于”);
(3)工业上制备PCl5通常分两步进行,先将P和Cl2反应生成中间产物PCl3,然后降温,再和Cl2反应生成PCl5。原因是____________;
(4)P和Cl2分两步反应生成1mol PCl5的ΔH3= ______;P和Cl2一步反应生成1mol PCl5的ΔH4 ______ΔH1(填“大于”,“小于”或“等于”);
(5)PCl5与足量水反应,最终生成两种酸,其化学方程式是______ 。
解析:(1)由图可以看出,1 mol P 在Cl2中完全燃烧生成1 mol PCl3,放出的热量为306kJ,所以P 在Cl2中完全燃烧生成PCl3的热化学方程式为:p(s) + 3/2Cl2(g) ===PCl3(g); ΔH =-306 kJ/mol或2P(s) + 3Cl2(g) ===2PCl3(g);ΔH ===-612 kJ/mol。(2)中间产物PCl3和未反应的Cl2的总能量高于最终产物PCl3的能量,其ΔH ===-93 kJ/mol,所以有:PCl5(g) ===PCl3(g)+ Cl2(g);ΔH ===93 kJ/mol。分解率α1 =(0.80 mol-0.60 mol)/ 0.80 mol×100%=25%;由热化学方程式知,此反应的正反应为吸热反应,所以升高温度,平衡向正反应方向移动,PCl5的分解率增大,即α2大于α1。(3)由图可以看出,P与Cl2反应生成PCl3,PCl3和Cl2进一步反应生成PCl5,都是放热反应,分两步进行且第二步降低温度,有利于PCl5的生成,防止PCl5的分解。(4)由盖斯定律可知,一步生成PCl5和两步生成PCl5的总热效应相等,即ΔH=(-612 kJ/mol)+(-93 kJ/mol)= -399 kJ/mol;(5)PCl5与足量水反应生成H3PO4和HCl,其化学方程式为:PCl5 + 4H2O===H3PO4 + 5HCl
答案:(1)2P(s) + 3Cl2(g) ===2PCl3(g); ΔH = -612kJ/mol
(2)PCl5(g) ===PCl3(g) + Cl2(g) ΔH =+ 93kJ/mol 25% 大于
(3)因为PCl5分解反应是吸热反应,温度太高,不利于PCl5的生成。
(4)-399 kJ/mol 等于
(5)PCl5 + 4H2O ===H3PO4 + 5HCl
点拨:热化学方程式的系数即可以用分数,也可以用整数。反应热随着系数的变化而变化。本题将化学图像与热化学方程式、反应热等概念结合起来很好地考查了考生的观察能力、思维能力等。要学会理解热化学方程式的含义,并能熟练地根据题给信息写出热化学方程式来。
【例题7】(2008年·海南)白磷与氧可发生如下反应:P4 + 5O2=P4O10。已知断裂下列化学键需要吸收的能量分别为:P-P a kJ·mol-1、P-O b kJ·mol-1、P=O c kJ·mol-1、O=O d kJ·mol-1。
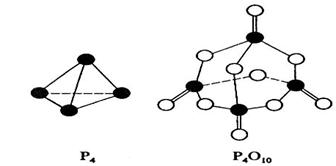
根据图示的分子结构和有关数据估算该反应的ΔH,其中正确的是______
A.(6a + 5d-4c-12b)kJ·mol—1
B.(4c + 12b-6a-5d)kJ·mol—1
C.(4c + 12b-4a-5d)kJ·mol—1
D.(4a + 5d-4c-12b)kJ·mol—1
解析:由图可以看出1 mol P4 中有6 mol P-P键,5 mol O2中有5 mol O=O键,1 mol P4O10中有4 mol P=O键、12 mol P-O键,所以ΔH =(6a + 5d-4c-12b)kJ·mol-1。
答案:A
点拨:化学反应的实质就是旧化学键的断裂和新化学键的形成,在断裂和形成的过程中伴随着能量的吸收和释放。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。1、2025 陕甘青宁 高温下MgCO 3 分解产生的MgO催化CO 2 与H 2 反应生成CH 4 ,部分历...
1.基元反应 一个化学反应往往需要经过多个反应步骤才能实现,每一步反应都称为基元反应...
一、热化学方程式的书写 与普通化学方程式相比,书写热化学方程式除了遵循书写普通化...
2017年高考化学考试说明中特别增加了一条:了解反应活化能的概念,了解催化剂的重要作...
方法技巧 解答能量变化图像题需要注意的几点。 (1)反应热不能取决于部分反应物能量和...
对于“环式”反应过程图像可表示为: (1)位于“环上”的物质一般是催化剂或中间体,如...