
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
对于可逆反应:mA(g)+ nB(g) pC(g)+ qD(g),在一定的温度下的任意时刻,反应物的浓度和生成物的浓度有如下关系:
pC(g)+ qD(g),在一定的温度下的任意时刻,反应物的浓度和生成物的浓度有如下关系:![]() ,
,![]() 叫该反应的浓度商。
叫该反应的浓度商。
![]() <K ,反应向正反应方向进行
<K ,反应向正反应方向进行
![]() =K ,反应处于平衡状态
=K ,反应处于平衡状态
![]() >K ,反应向逆反应方向进行
>K ,反应向逆反应方向进行
例4:(原创题)在一定温度条件下,对于以达到平衡的反应:FeCl3 +3KSCN ![]() 3KCl+Fe(SCN)3 ,在此溶液中作如下处理,平衡左移的是:()
3KCl+Fe(SCN)3 ,在此溶液中作如下处理,平衡左移的是:()
A.加入少量氯化钾固体 B.加入少量氯化铁固体 C.减少Fe(SCN)3的浓度 D.加水稀释
解析:该反应的本质是:Fe3+ +3SCN- ![]() Fe(SCN)3,任意时刻的浓度商:
Fe(SCN)3,任意时刻的浓度商:![]() ;KCl没有参加反应,所以改变KCl的量不会影响到平衡的移动,故A错误;加入少量氯化铁固体或减少Fe(SCN)3的浓度,都会使
;KCl没有参加反应,所以改变KCl的量不会影响到平衡的移动,故A错误;加入少量氯化铁固体或减少Fe(SCN)3的浓度,都会使![]() 减小,使
减小,使![]() <K ,平衡向右移动,故B、C均错;加水稀释,使
<K ,平衡向右移动,故B、C均错;加水稀释,使![]() 、
、 ![]() 和
和![]() 均减小,但分母减小的更快,使
均减小,但分母减小的更快,使![]() >K,平衡向左移动,故D正确;答案选D。
>K,平衡向左移动,故D正确;答案选D。
四、计算转换率
利用温度不变时,平衡常数不变列方程求解。
例5:(08年宁夏理综)已知可逆反应:M(g)+N(g)![]() P(g)+Q(g),△H>0,请回答下列问题:
P(g)+Q(g),△H>0,请回答下列问题:
(1)在某温度下,反应物的起始浓度分别为:c(M)= 1 mol·L-1,c(N)=2.4 mol·L-1,达到平衡后,M的转化率为60%,此时N的转化率为 ;
(2)若反应温度升高,M的转化率 (填“增大”“减小”或“不变”;)
(3)若反应温度不变,反应物的起始浓度分别为:c(M)= 1 mol·L-1,c(N)=a mol·L-1;达到平衡后,c(P)=2 mol·L-1,a= ;
(4)若反应温度不变,反应物的起始浓度为:c(M) = c(N)= b mol·L-1,达到平衡后,M的转化率为 。
解析:
(1)M转化的物质的量为0.6 mol·L-1,则N反应的量也是0.6 mol·L-1,所以N的转化率为:×100%=25%。
(2) 由于该反应的正反应为吸热反应,所以升高温度,化学平衡正向移动,M的转化率增大。
(3) M(g)+N(g)![]() P(g)+Q(g)
P(g)+Q(g)
起始Ⅰ:1 2.4 0 0
平衡Ⅰ:0.4 1.8 0.6 0.6
起始Ⅱ:4 a 0 0
平衡Ⅱ:2 a-2 2 2
平衡Ⅰ和平衡Ⅱ温度相同,则K值相同,
故: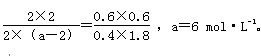
(4) M(g)+N(g)![]() P(g)+Q(g)
P(g)+Q(g)
起始: b b 0 0
改变: x x x x
平衡: (b-x) (b-x) x x
温度不变,K值相同,故:

点评:通过以上几个案例的分析,化学平衡常数在无机化学的解题中占有非常重要的位置;其用途之广,概括起来,无非是直接应用和综合应用两个方面。通过平衡常数可以直接判断一个反应进行的程度;也可以间接的通过平衡常数来判定反应的热效应和反应进行的方向;通过平衡常数也可以很好的解释浓度、压强和催化剂对平衡的影响;当然,平衡常数还可以应用于各种计算,求某些特定物质的转换率和浓度。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。
 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。
...
一、公式提出的背景 19世纪末,化学家们逐渐意识到温度对化学...
假设对于反应 a A(g) + b B(g) g G(g) + h H(g) 中各物质均为理想气体,...
例:某温度、起始压强为100 kPa下,若将2mol SO 2 和1molO 2 ,通入恒...
...
什么是活化能、能垒? 1 、能垒 活化分子含有的能参加化学反应...