
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
关于甲烷的制备和性质的教学若不依靠实验,或者实验效果不太理想,只凭教师口述或板书,就会影响教学效果。但是,如果按照教材的描述进行实验,则效果并不理想,且存在着一定的问题。实验要求必须尽可能地除尽药品中所吸收的微量水分,并在研细、混合、装入试管等操作过程,这样不但影响培养学生的基本实验技能,还会使实验复杂化;实验时生成甲烷的量少,速度也慢,难以连续点燃,即使点燃后,火焰也并理论上的淡蓝色,而呈浅黄色,效果不够理想;制取的甲烷因含有杂质,有时会使溴水或高锰酸钾溶液退色,与理论不符等等。
针对上述问题,我们改用碳化铝水解的方法制备甲烷,使实验现象和理论叙述得到统一,收到了良好的效果。
一、实验原理 反应方程式:Al4C3 + 12H2O ==== 3CH4 + 4Al(OH)3(条件加热)
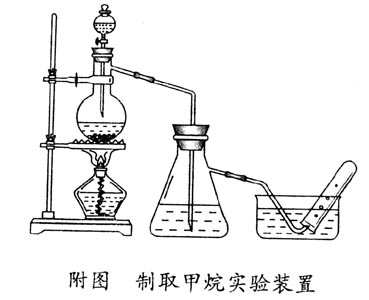
二、实验装置
三、实验步骤
称取7g碳化铝,放入250mL的蒸馏烧瓶内。蒸馏烧瓶上口配置一单孔塞,插入盛有30mL蒸馏水的100mL的滴液漏斗,蒸馏烧瓶的支管口连接一盛有NaOH的洗气装置(可用抽滤瓶代用),依次连接导气管并通入水槽。将蒸馏烧瓶用铁夹固定在铁架台上,隔一石棉网,用酒精灯加热,使蒸馏烧瓶内的反应物始终保持微沸,这样可使反应平缓的发生,气体均匀地连续逸出。若反应太剧烈,则从漏斗管注入冷水使其缓和。这样,可以制取大量的甲烷,依次收集数试管的甲烷气体供性质试验用,然后再用安全点火法进行点燃试验,火焰确为淡蓝色。
该实验操作简便,需要的时间短,且具有制备的甲烷气体量足,点燃后火焰确为淡蓝色,气体中无使溴水和高锰酸钾退色的杂质,实验现象明显等优点,若进行课堂演示实验尤为适宜。
四、问题讨论
1.实验装置的安装应遵循从下到上,从左到右的原则。拆卸时则相反。
2.用NaOH溶液作洗液,一方面可除去杂质所产生的磷化氢、硫化氢等酸性气体,另一方面可使从导管逸出的水蒸气得以冷凝而除去之。
3.实验必须控制好热源,使反应物始终保持微沸,这样一方面可以使用权反应安全平缓的进行下去,另一方面可防止水变为蒸气而逸出。
4.反应完毕后应先拔掉连接洗气装置的导管,然后再移开热源。反之,会发生倒吸现象。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。
 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。
甲烷与氯气的取代反应 实验现象: 1)试管内气体颜色(黄绿色)逐...
苯是重要的有机工业原料,它是中学有机化学中最重要的有机物...
我们都知道酒精是液态的,但是火锅店中常见的燃料——固体酒...
硝基苯制取实验 硝酸硫酸冷滴苯, 黄色油物杏仁味。 温计悬浴...
有机化学实验室大量制备乙酸乙酯通常经过反应回流和产物蒸馏...
问题 1 、在酯化反应的实验过程中,药品的添加顺序 在旧人教版...