
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
2017年高考化学考试说明中特别增加了一条:了解反应活化能的概念,了解催化剂的重要作用。2018年的与2017年一样,没有改变,2019年也没有变化。
高考题中通过反应历程图考查催化剂是一个什么的演变过程,下面通过一系列的高考题就可以看出一点端倪。
一、题源——教材中的示意图
1、苏教版如图:
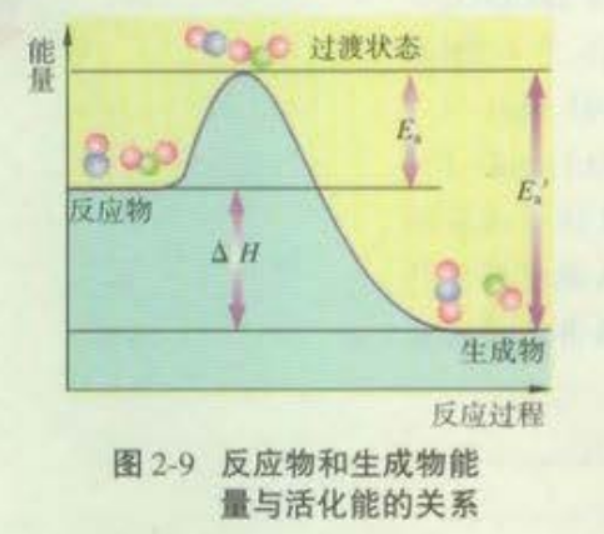
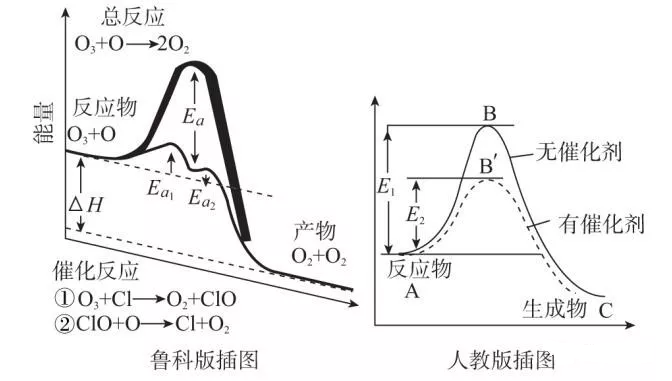
图中:Ea为正反应的活化能,Ea′为逆反应的活化能,
反应热为△H =Ea-Ea′。
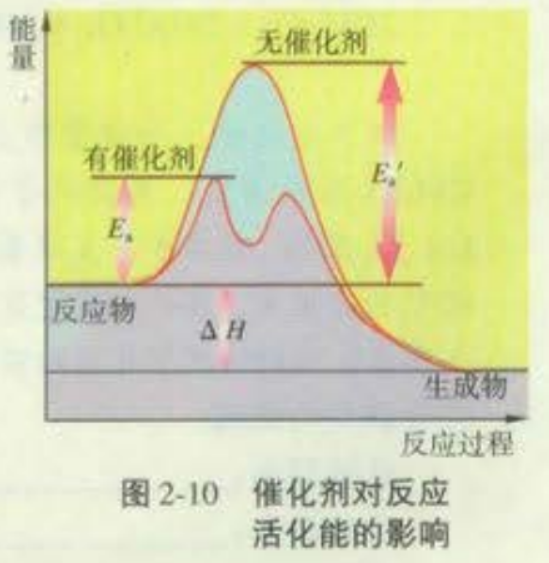
注意:图中使用催化剂时的活化能为Ea1。示意图中有两个峰。
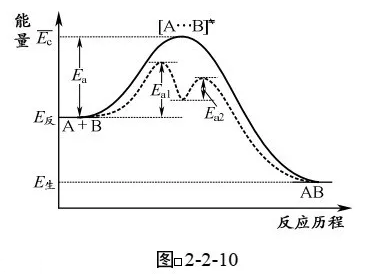
如图2-2-10所示:反应A+B→AB的活化能为瓦,加入催化剂K后,反应分两步进行:
①A+K→AK 活化能为Ea1(慢反应)
②AK+B→AB+K 活化能为Ea2(快反应)
总反应: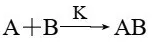 活化能为Eal
活化能为Eal
可以看出,加入催化剂K后,两步反应的活 化能Eal和Eal均小于原反应的活化能£a,因此反应速 率加快。
仔细分析这两步反应可以看山:由于Ea1>Ea2,第1步反应是慢反应,是决定整 个反应快慢的步骤,称为“定速步骤”或“决速步骤”,第1步反应越快,则整体反应速率就越快。因此对总反应来说,第一步反应的活化能Ea1就是在催化条件下总反应的活化能。
2、鲁科版及人教版如图:
二、高考题考查的演变
1、(2011全国大纲卷,T9)反应A+B→C(△H<0)分两步进行:①A+B→X(△H>0),②X→C(△H<0)。下列示意图中,能正确表示总反应过程中能量变化的是
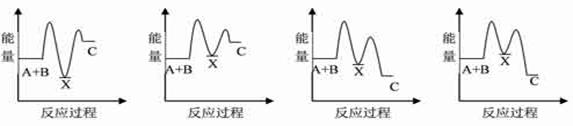
【答案】D
【解析】由反应A+B→C(△H<0)分两步进行①A+B→X(△H>0)②X→C(△H<0)可以看出,A+B→C(△H<0)是放热反应,
A和B的能量之和C,由①A+B→X(△H>0)可知这步反应是吸热反应,X→C(△H<0)是放热反应,故X的能量大于A+B;A+B的能量大于C,X的能量大于C。
2、(2018·海南卷,T12)炭黑是雾霾中和重要颗粒物,研究发现它可以活化氧分子,生成活化氧,活化过程的能量变化模拟计算结果如右图所示。活化氧可以快速氧化二氧化硫。下列说法正确的是
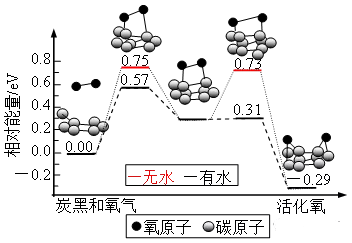
A.每活化一个氧分子吸收0.29eV的能量
B.水可使氧分子活化反应的活化能降低0.42eV
C.氧分子的活化是O—O的断裂与C—O键的生成过程
D.炭黑颗粒是大气中二氧化硫转化为三氧化硫的催化剂
【答案】CD
解析:由活化过程的能量变化模拟图可知,每活化一个氧分子放出0.29eV的能量,A项错误;水可使氧分子活化反应的活化能降低包括两部分,类似前面示意图中的两个峰,但是活化能变化是第一个。所以炭黑与氧气生成中间产物使活化能降低0.18eV,B项错误;结合图示,比较反应物与目标物质的结构可知,C项正确;根据“活化氧可以快速氧化二氧化硫”可以判定,D项正确。
3、(2019·全国1卷,T28)(3)我国学者结合实验与计算机模拟结果,研究了在金催化剂表面上水煤气变换的反应历程,如图所示,其中吸附在金催化剂表面上的物种用标注。
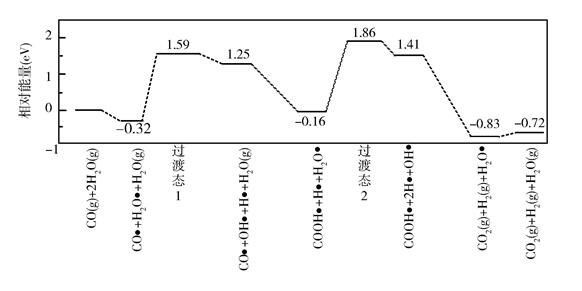
可知水煤气变换的ΔH____0(填“大于”“等于”或“小于”),该历程中最大能垒(活化能)E正=__eV,写出该步骤的化学方程式_______。
(3)由题中图示可知水煤气变换时反应前相对能量0eV,反应后相对能量-0.72eV,反应为放热反应,故△H小于零。该历程中最大的能垒(活化能)应是COOH*+H*+H2O*=COOH*+2H*+OH*反应时由相对能量-0.16eV升至1.86eV 的过渡态2再降至1.41eV。E正=1.86-(-0.16)=2.02(ev)。
题中设问“该历程中最大能垒(活化能)”,需要对活化能加深认知,为能量上升阶段,可知最大的活化能为﹣0.16到1.86阶段。
三、启示
1、反应示意图由简单变复杂。前面只考查反应物生成物相对能量的大小,判断放热吸热反应。通过示意图波峰高低来判断有无催化剂。
2、单峰变双峰。考查我们哪个峰才是催化剂改变的活化能。
3、示意图与物质的分子模型结合,加大信息的干扰作用。
4、示意图由定性判断变成定量计算焓变。
5、示意图变成能垒图,通过相对能量来计算活化能。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。
 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。
1、2025 陕甘青宁 高温下MgCO 3 分解产生的MgO催化CO 2 与H 2 反应生...
1.基元反应 一个化学反应往往需要经过多个反应步骤才能实现...
一、热化学方程式的书写 与普通化学方程式相比,书写热化学方...
2017年高考化学考试说明中特别增加了一条:了解反应活化能的概...
方法技巧 解答能量变化图像题需要注意的几点。 (1)反应热不能...
对于“环式”反应过程图像可表示为: (1)位于“环上”的物质一...