
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
原电池是将化学能转变成电能的装置,构成 原电池的一般条件是:
1.两个活泼性不同的电极;
2.电解质溶液;
3.形成闭合回路;
4.能自发发生氧化还原反应。
通常是活泼的金属作负极,金属本身被氧化; 不活泼的金属或非金属作正极,溶液中的阳离子 被还原。
以上“一般”“通常”的描述,是指有许多原电 池表面上不符合以上的规律,却能够放电;有的看似符合构成原电池的条件,却又不能产生电流。
现将一些具有“反常”现象的例子,归纳分析如 下,以便于理解学习。
一、两个电极的材料相同
1.氢氧燃料电池
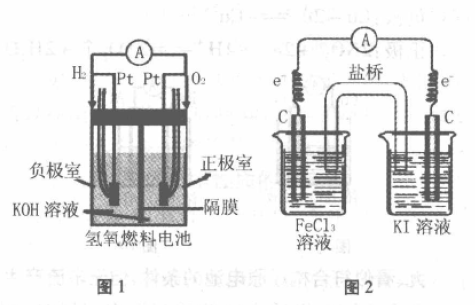
装置如图1所示,两个电极都是Pt,但H2、O2 吸附在Pt上产生电位差,使反应发生。
负极:2H2 -4e-+4OH-=4H2O
正极:O2 +4e- +2H2O=4OH-
二、正极材料为金属氧化物,电极本身被还原
1.银锌电池
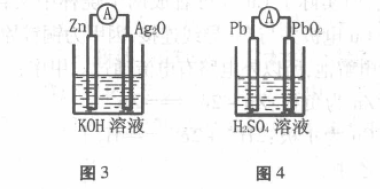
装置如图3所示,正极材料为Ag2O,负极材 料为Zn,Ag2O本身就是氧化剂,Zn电极上流出的 电子直接还原Ag2O成Ag,多余的氧与H2O再 结合成OH-。
负极:Zn-2e- +2OH-=Zn(OH)2 正极:Ag2O+2e- +H2O=2Ag+2OH-
2.铅蓄电池
装置如图4所示,正极材料为PbO2,负极材 料为Pb,PbO2本身就是氧化剂,Pb电极上流出的 电子直接还原PbO2生成PbSO4,多余的氧再与 H +结合成H2O。
负极:Pb-2e- +SO42- =PbSO4
正极:PbO2 +2e- +SO42-+4H+ =PbSO4 +2H2O
三、两个电极都是化合物,电极本身发生氧化 还原反应
如镍氢电池:负极材料是储氢合金LaNi5H6; 正极材料是NiO(OH)。
电极本身发生氧化还原反应:
LaNi5H6 +6NiO(OH)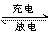 LaNi5 +6Ni(OH)2
LaNi5 +6Ni(OH)2
四、电解质是非溶液
1. 锂电池
(-)Li | LiI 晶体 | I2( +)
负极:2Li-2e-=2Li+
正极:I2+2e-=2I-
2. MCFC燃料电池
(-)H2 | 熔融 K2CO3 | O2( +)
电解质为熔融的K2CO3;。
负极:2H2-4e- +2CO32-=2CO2+2H2O
正极:O2+4e-+2CO2 =2CO32-
3.锂亚硫酰氯电池
此类电池用于心脏起博器,电解质是LiAlCl -SOCl2(无水),C棒为正极,Li为负极。
负极:8Li-8e-=8Li+
正极:3SOCl2+8e- =2S+SO32-+6Cl-
五、看似不能构成闭合回路
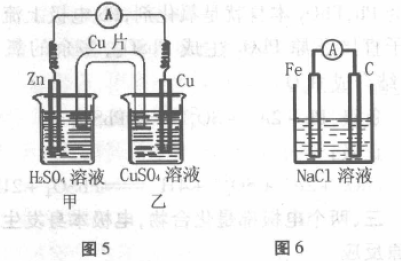
装置如图5所示,如用盐桥连接甲、乙两个烧 杯,则离子可以在两个烧杯中迁移,构成闭合回 路,产生电流。若用铜片代替盐桥,因离子不能从 Cu片上通过,看似不能形成闭合回路,不能产生 电流,但实际上Cu片可看成两个烧杯中又各插入 一个Cu电极并与Cu导线连接,因甲为铜锌原电池, 乙为电解池,所以外电路有电流通过。
甲中:
Zn 为负极:Zn-2e-=Zn2+
Cu 为正极:2H+ +2e-=H2
乙中:
阳极:Cu-2e-=Cu2+
阴极:Cu2++2e-==Cu
六、看似不能自发发生氧化还原反应
装置如图6所示,Fe与NaCl溶液不能自发 地发生氧化还原反应,看似不符合构成原电池的 条件。但实验测得外电路上有电流通过,其原因 是溶解在食盐水中的O2分子充当了氧化剂,发生 了吸氧腐蚀而构成原电池。电极反应:
负极:2Fe-4e-=2Fe2+
正极:O2 +2H2O+4e-==4OH-
七、铁做负极,氧化产物为Fe3+,溶液中的阴 离子被还原
装置如图7所示,Fe做负极,用稀HNO3做电 解质,最终生成Fe3+,正极不是溶液中的阳离子被还原,而是阴离子被还原。
电极反应:
负极:Fe-6e-=3Fe2+
正极:2NO3-+6e- +8H+= 2NO +4H2O
3Fe2++NO3- +4H+=3Fe3++NO +2H2O
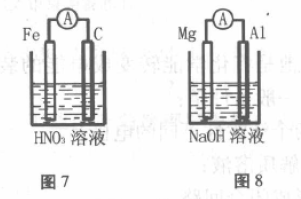
八、金属活泼性较强的为正极,金属活泼性较弱的为负极
在一些特定电极和电解质溶液中,金属活泼 性较强的为正极,金属活泼性较弱的反而为负极, 与由金属活泼性强弱判断正、负极相反。
1. 装置如图8所示,用NaOH作电解质溶 液,A1能与NaOH溶液发生置换反应,而Mg却不 能反应。因此金属性较弱的A1为负极,金属性较 强的Mg为正极。
负极:2Al-6e- +8OH-=2Al3+ +4H2O
正极:6H2O+6e-=3H2 +6OH-
2. 装置如图9所示,用浓硝酸做电解质溶 液,因Fe发生钝化,生成一层致密的氧化膜保护 了 Fe,所以Cu比钝化的Fe更活泼,更易失去电 子,因此,金属性比较弱的Cu为负极,金属性较 强的Fe反而为正极。
负极:Cu-2e-=Cu2+
正极:2NO3-+2e- +4H+=2NO2 +2H2O
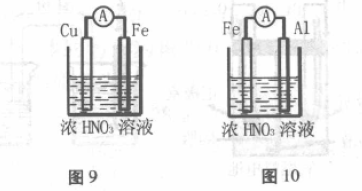
九、看似符合构成原电池的条件,但无电流产生
两个不同电极插人电解质溶液中,且构成闭 合回路,但有可能不能构成原电池。
装置如图10所示,Fe和Al在冷的浓硝酸中 都能“钝化”,在其表面形成一层致密氧化膜,导 致放电反应不能发生。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。
 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。
化学能是内能中与化学键相关的一部分;而焓是一个包含内能,...
先说说放热反应和吸热反应。有同学错误地认为: “ 吸热反应...
先说说放热反应和吸热反应。有同学错误地认为: “ 吸热反应...
1 . KClO 3 分解制 O 2 ,为什么加入一些 MnO 2 ? 因为 MnO 2 对 KC...
原电池是把化学能转化为电能的装置,在原电池的两极发生氧化...
原电池是将化学能转变成电能的装置,构成 原电池的一般条件是...