
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
化学能是内能中与化学键相关的一部分;而焓是一个包含内能,并考虑到在常压环境下做功便利性的复合能量函数。
一、化学能

化学能是物质内部由于化学键的断裂和形成而储存或释放的能量,本质上是化学键的键能,只有在发生化学反应时才会转化为其他形式的能量(如热能、光能)。
化学能是内能的一部分。
二、内能
内能(通常用符号U表示)指物质系统内部所有微观粒子(分子、原子等)的动能和势能的总和,包括化学能(化学键蕴含的能量)+分子运动能(与温度相关)+分子间作用能(与物态、压强相关)+电子能……等。
简单来说,内能是系统所有微观能量的总和。
内能的定义过于广泛,我们无法直接测量它的绝对值。
其变化量(ΔU)的测量也非常麻烦,因为它同时依赖于热(Q)和功(W)两种传递方式(ΔU=Q+W)。
而功(W)可以包含体积功、电功、机械功等多种形式,在复杂过程中很难全部精确计量。
所以“内能”这个概念在生产实践中并不好用,怎么办呢?
焓(H)的创造提供了“优雅解决方案”!
三、焓
在化学中,我们最关心的是“一个反应是吸热还是放热,以及放出/吸收多少热”,即“反应热”。
但在一个体积可能变化的过程中(比如气体反应),内能的变化(ΔU)并不等于系统释放或吸收的热量(Q),因为一部分能量会以“功”的形式交换。
焓的定义是H=U+pV。这个看似简单的组合,却带来了巨大的便利。
它的核心优势在于:在恒压且只做体积功的条件下,系统的焓变(ΔH)直接等于系统与环境交换的热量(Q)。即:
ΔH=Q
我们可以从热力学第一定律出发推导一下:
1、热力学第一定律:ΔU=Q+W
2、在恒压且只做体积功的条件下:W=-pΔV
3、代入第一定律:ΔU=Q-pΔV
4、整理得到:Q=ΔU+pΔV
5、将U+pV 定义为焓(H),即H=U+pV。
焓(H)不是一个“新”的能量,而是内能(U)加上一个“pV”修正项。
6、可得在恒压下:ΔH=Q
焓(H)是一个极具智慧的发明,它将内能和体积功打包,使得在最常见的实验条件(恒压)下,能量的计算和测量变得非常直接。
这就是为什么在化学中,我们讨论反应热时,几乎总是在讨论“焓变(ΔH)”,而不是“内能变(ΔU)”。
在实验室和工厂里,大部分反应都是在“敞口容器”(常压)下进行的,而“焓”就是为了优雅地处理这种“常压过程”而诞生的完美工具。
焓带来的实际便利
1、直接测量反应热:现在,要得到一个化学反应的“热效应”,我们不需要去费力地测量内能变化和体积功。
我们只需要在一个敞口的杯子(保证恒压)里进行反应,用一个简单的热量计测量它放出或吸收的热量(Q),这个数值就直接等于焓变(ΔH)。
ΔH<0:放热反应,我们直接知道释放了多少热。
ΔH>0:吸热反应,我们直接知道吸收了多少热。
2、简化计算和制表:正因为焓变(ΔH)在恒压下等于可测的热量,我们可以像列目录一样,制作出各种物质的标准摩尔生成焓(ΔHf°)表。
要计算任何反应的反应热,只需要用生成物的总生成焓减去反应物的总生成焓即可。
如果只用内能(U),我们将无法制作出这样方便实用的数据库。
3、专注于“化学意义”:焓变(ΔH)让我们可以忽略复杂的机械功(如活塞运动、气体膨胀收缩),而直接关注于化学反应本身的能量特性——化学键的断裂和形成所导致的净能量流动。
这更符合化学家的思维模式。
四、“反应进程—势能图”的纵坐标表示什么?
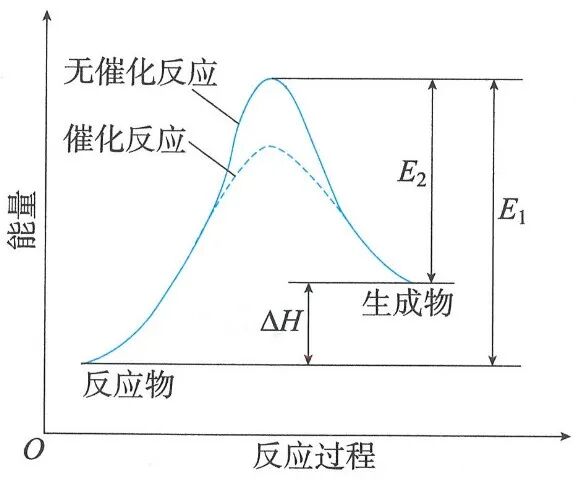
“反应进程—势能图”是用来直观描述“系统的势能”在化学反应过程中随化学键重组引起的的变化。
所以图中的纵坐标“能量”最精确的说法是 表示“内能中由化学键构型决定的部分”。
也可以理解为 “系统的内能(U)在反应进程上的投影” 。
在高中阶段,通常把图中纵坐标的变化量(Δ纵坐标)等于反应的焓变(ΔH)。
为了方便理解,在基础化学中将其纵坐标标记为“焓(H)”或“能量”是完全可行且实用的。
在忽略一些微小差异的情况下,这种理解在化学层面是富有成效且基本正确的。
对于绝大多数化学反应,反应过程中由体积变化引起的pΔV功非常小,与内能变化ΔU和焓变ΔH相比可以忽略不计(通常小于1%)。
因此:ΔH=ΔU+pΔV≈ΔU。
而反应进程图纵坐标表示的势能变化,本质上就是系统内能中与化学键相关的部分变化,即Δ(势能)≈ΔU。
所以,最终Δ(纵坐标)≈ΔH。
实例分析:敞口烧杯中的氢气燃烧
查“标准燃烧焓表”可知:
2H₂(g)+O₂(g)→2H₂O(l) ΔH=-572 kJ/mol
我们假设在室温(298K)和常压(1 atm)下,反应恰好按方程式进行。
反应物:2 mol H₂(g)+1 mol O₂(g),总共3 mol气体。
Vm=24.5 L/mol,则V(气)=24.5 L/mol×3 mol=73.5 L=0.0735 m³
生成物是液态水,其体积与气体相比微不足道,可以近似为 0。
所以,ΔV=0-0.0735 m³=-0.0735 m³。
带入公式:pΔV=(101325 Pa)×(-0.0735 m³)≈-7450 J=-7.45 kJ。
体积功7.45 kJ与反应放出的热量572 kJ相比,完全可以忽略不计。
因此:ΔH=ΔU+pΔV≈ΔU。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。化学能是内能中与化学键相关的一部分;而焓是一个包含内能,并考虑到在常压环境下做功...
加热一般是指使用酒精灯提供的热量使反应持续进行; 高温是指所需温度超过了酒精灯能...
先说说放热反应和吸热反应。有同学错误地认为: “ 吸热反应是吸收了热量,所以反应体...
先说说放热反应和吸热反应。有同学错误地认为: “ 吸热反应是吸收了热量,所以反应体...
化学平衡理论是中学化学最重要的基础理论之一,是研究可逆反应、弱电解质电离、盐类水...
1 . KClO 3 分解制 O 2 ,为什么加入一些 MnO 2 ? 因为 MnO 2 对 KClO 3 的分解有催...