
|
学习小专题 |

|
学习小专题 |
 [注解与辨疑a] 浅谈最外层电子的作用 作者:邵磊 来源:未知 日期:2016-01-24 19:30:19 点击:15601 所属专题:最外层电子 价电子
[注解与辨疑a] 浅谈最外层电子的作用 作者:邵磊 来源:未知 日期:2016-01-24 19:30:19 点击:15601 所属专题:最外层电子 价电子
一、最外层电子可以确定物质的化学键类型 一般说来,最外层电子数大于4的原子与最外层电子数小于4的原子彼此间容易得失电子形成阴阳离子,离子间以静电吸引力作用而形成离子键(如NaCl);最外层电子数大于或等于4的原子间容易共用电子对而形成共价键(如N≡N,C-C);...
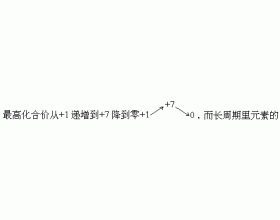 [探讨与扩展a] 过渡元素 作者:羊绍敬 来源:未知 日期:2021-12-29 13:43:51 点击:16806 所属专题:过渡元素
[探讨与扩展a] 过渡元素 作者:羊绍敬 来源:未知 日期:2021-12-29 13:43:51 点击:16806 所属专题:过渡元素
过渡元素之一 元素周期表(长式)中从ⅢB族到ⅡB族10个纵行,包括镧系和锕系元素习惯上把它们叫做过渡元素,这些元素在周期表里的位置是介于典型金属和典型非金属之间的,表示由金属性向非金属性过渡的意思。 过渡元素之二 过渡元素的含义各书说法不一,可分狭义广义两...
 [注解与辨疑d] 3d轨道和4s轨道,哪个轨道能量大? 作者:王欣华 来源:未知 日期:2012-11-29 12:57:41 点击:15877 所属专题:能级09
[注解与辨疑d] 3d轨道和4s轨道,哪个轨道能量大? 作者:王欣华 来源:未知 日期:2012-11-29 12:57:41 点击:15877 所属专题:能级09
当3d轨道没有电子填充时,3d轨道的能量大于4s轨道能量(例如Na原子和 Ca原子);当3d轨道上已填充上电子时,4s轨道的能量大于3d轨道的能量(例如Ti原子和V原子)。因为3d轨道上填充有电子时,由于它对 4s电子产生屏蔽作用,使4s轨道电子能量升高的结果....
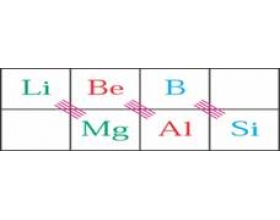 [探讨与扩展a] 化学上的对角线规则 作者:李开振 来源:未知 日期:2013-04-15 10:43:31 点击:28590 所属专题:对角线规则
[探讨与扩展a] 化学上的对角线规则 作者:李开振 来源:未知 日期:2013-04-15 10:43:31 点击:28590 所属专题:对角线规则
1.对角线规则 对比周期系中元素性质,发现: 左上~右下,对角线元素性质相似──对角线规则 周期系中如上三对元素对角关系明显。 对角线规则主要是从性质总结出来的经验规律,可从离子极化概念粗略解释。 2.对角元素性质的相似性 仅以B和Si这一对元素为例列举如下: 性质 B ...
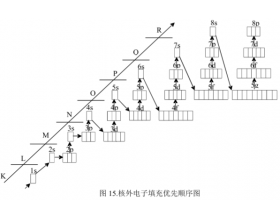 [注解与辨疑d] 原子核外电子排布规则解读 作者:shulongchang2008@163.com 来源:未知 日期:2021-12-17 10:20:31 点击:23977 所属专题:核外电子排布规则
[注解与辨疑d] 原子核外电子排布规则解读 作者:shulongchang2008@163.com 来源:未知 日期:2021-12-17 10:20:31 点击:23977 所属专题:核外电子排布规则
1、Pauli不相容原理:每个轨道最多只能容纳两个电子,且自旋相反配对 2、能量最低原理:电子尽可能占据能量最低的轨道 3、Hund规则:简并轨道(能级相同的轨道)只有被电子逐一自旋平行地占据后,才能容纳第二个电子 另外:等价轨道在全充满、半充满或全空的状态是比较...
 [探讨与扩展a] 元素的电负性 作者:杨董 来源:未知 日期:2016-01-24 20:17:53 点击:19470 所属专题:电负性
[探讨与扩展a] 元素的电负性 作者:杨董 来源:未知 日期:2016-01-24 20:17:53 点击:19470 所属专题:电负性
元素的原子在分子中吸引电子的能力叫元素的电负性。元素的电负性愈大,表示该元素原子吸引电子的能力愈大,生成阴离子的倾向愈大。反之,吸引电子的能力愈小,生成阳离子的倾向愈大。表1列出了元素的电负性数值。元素的电负性是相对值,没有单位。通常规定氟的电负性为4...
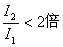 [注解与辨疑d] 反映元素性质的两个重要数据—电离能与电负性 作者:张劲辉 来源: 日期:2012-11-29 13:02:18 点击:37345 所属专题:电离能 电负性
[注解与辨疑d] 反映元素性质的两个重要数据—电离能与电负性 作者:张劲辉 来源: 日期:2012-11-29 13:02:18 点击:37345 所属专题:电离能 电负性
一、电离能 电离能是指从气态原子中去掉电子把它变成气态阳离子,需要克服核电荷的引力而消耗的能量。符号为I,单位常用电子伏特。从元素的气态原子去掉一个电子成为+1价气态阳离子所需消耗的能量,称为第一电离能(I 1 );从+1价气态阳离子再去掉一个电子成为+2价气...
 [探讨与扩展a] 原子核外电子排布的原理及方法 作者:程新 来源: 日期:2021-12-17 09:21:45 点击:19467 所属专题:核外电子排布
[探讨与扩展a] 原子核外电子排布的原理及方法 作者:程新 来源: 日期:2021-12-17 09:21:45 点击:19467 所属专题:核外电子排布
一、原子核外电子排布的原理 处于稳定状态的原子,核外电子将尽可能地按能量最低原理排布,另外,由于电子不可能都挤在一起,它们还要遵守保里不相容原理和洪特规则,一般而言,在这三条规则的指导下,可以推导出元素原子的核外电子排布情况,在中学阶段要求的前 36号...
 [探讨与扩展a] 原子物理名词解释 作者:樊会武 来源:摘抄于因特网 日期:2012-12-03 10:44:12 点击:15409 所属专题:原子结构03
[探讨与扩展a] 原子物理名词解释 作者:樊会武 来源:摘抄于因特网 日期:2012-12-03 10:44:12 点击:15409 所属专题:原子结构03
α射线: α射线是从放射性物质中射出来的一种粒子流。α粒子就是氦原子核,它贯穿物质的本领很小,一张薄线通常就能把它档住,但是它有很强的电离作用。 β射线: β射线是高速的电子流。它的贯穿本领较大,能穿透几毫米厚的铝板,但它的电离作用较弱。 γ射线: γ射...
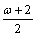 [方法与规律a] 怎样确定复杂原子的核外电子分层排布 作者:李萱 来源:摘抄于因特网 日期:2022-08-05 17:40:39 点击:28380 所属专题:核外电子分层排布
[方法与规律a] 怎样确定复杂原子的核外电子分层排布 作者:李萱 来源:摘抄于因特网 日期:2022-08-05 17:40:39 点击:28380 所属专题:核外电子分层排布
一、电子层容量原理 在原子核外电子排布中,每个电子层最多容纳的电子数为2 n 2 ,这个规律在一些无机化学教材中叫做最大容量原理。我认为,该原理并不能全面反映原子核外电子排布的真实情况,其一,它只适合于离核近的内电子层,且不是最大,而是等于2 n 2 ;其二,离...
 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。电离能和电子亲和能都是研究元素游离态的原子的性质。电离能是衡量元素金属性大小的物...
硼,元素符号B,价电子构型2s 2 2p 1 ,第二周期第ⅢA族。 作为非金属,最高氧化数对...
多电子原子中,在考虑某个电子时,可以把其他电子对其排斥作用看作削弱了原子核对它的...
1.核外电子共有几个能层? 能层电子层,根据离原子核远近的不同,由里向外可分为第一、二...
1.一个电子的运动状态要从哪几个方面描述? 答:应从这个电子所处的能层(电子层)是第...
...
基态和激发态 什么是光谱? 光谱:不同元素的原子发生跃迁时会 吸收 ( 基态→激发态 ...
鲍林的能级图只是个近似的能级图,是帮助我们理解电子的填充过程。 但电子填充后轨道...