
|
学习小专题 |

|
学习小专题 |
 [注解与辨疑d] 电子排布式与外围电子排布式辨析 作者:耿艳 来源:未知 日期:2015-12-11 19:50:42 点击:10606 所属专题:电子排布式
[注解与辨疑d] 电子排布式与外围电子排布式辨析 作者:耿艳 来源:未知 日期:2015-12-11 19:50:42 点击:10606 所属专题:电子排布式
主族元素: 最外层电子排布式=价电子排布式=外围电子排布式=特征电子构型 过渡元素: 价电子排布式=外围电子排布式=特征电子构型≠最外层电子排布式。即过渡元素不仅是最外层电子,次外层电子及某些元素的倒数第三层电子也可成为价电子。 外围电子=成键电子+非成键电子 ...
1、共价半径: 同种元素的两个原子, 以两个电子用共价单键相连时, 核间距的一半, 为共价半径. 如: H 2 X 2 等同核单键双原子分子, 均可测得其共价半径. 2、金属半径: 金属晶体中, 金属原子被看为刚性球体, 彼此相切, 其核间距的一半, 为金属半径. . 3、范德华半径: 单原...
 [注解与辨疑d] 能级组与周期 作者:吴旭东 来源:未知 日期:2016-01-30 12:11:47 点击:14669 所属专题:能级09
[注解与辨疑d] 能级组与周期 作者:吴旭东 来源:未知 日期:2016-01-30 12:11:47 点击:14669 所属专题:能级09
第一能级组 1s 2电子 第一周期 2种元素 第二能级组 2s,2p 8电子 第二周期 8种元素 第三能级组 3s,3p 8电子 第三周期 8种元素 第四能级组 4s,3d,4p 18电子 第四周期 18种元素 第五能级组 5s,4d,5p 18电子 第五周期 18种元素 第六能级组 6s,4f,5d,6p 32电子 第六周期 32种...
 [注解与辨疑d] 四个量子数的意义和相互关系 作者:张修鹏 来源:未知 日期:2019-05-21 08:47:46 点击:114370 所属专题:量子数 核外电子排布 能层
[注解与辨疑d] 四个量子数的意义和相互关系 作者:张修鹏 来源:未知 日期:2019-05-21 08:47:46 点击:114370 所属专题:量子数 核外电子排布 能层
四个量子数在量子力学中用来描述原子内核外电子运动的状态。 一、主量子数(n) 主量子数是描述核外电子距离核的远近,电子离核由近到远分别用数值n=1,2,3,…有限的整数来表示,而且,主量子数决定了原子轨道能级的高低,n越大,电子的能级越大,能量越高。n是决定电子能...
 [注解与辨疑d] 元素基态电子排布式 作者:秦文鑫 来源:未知 日期:2013-04-09 10:10:27 点击:19065 所属专题:电子排布式
[注解与辨疑d] 元素基态电子排布式 作者:秦文鑫 来源:未知 日期:2013-04-09 10:10:27 点击:19065 所属专题:电子排布式
原子序数 元素 电子构型 原子序数 元素 电子构型 原子序数 元素 电子构型 1 H 1s 1 38 Sr [Kr]5s 2 75 Re [Xe]4f 14 5d 5 6s 2 2 He 1s 2 39 Y [Kr]4d 1 5s 2 76 Os [Xe]4f 14 5d 6 6s 2 3 Li [He]2s 1 40 Zr [Kr]4d 2 5s 2 77 Ir [Xe]4f 14 5d 7 6s 2 4 Be [He]2s 2 41...
 [注解与辨疑d] 原子最外层、次外层及倒数第三层最多容纳电子数的解释 作者:胡长胜 来源:未知 日期:2018-07-17 13:18:29 点击:12233 所属专题:核外电子排布 最外层电子
[注解与辨疑d] 原子最外层、次外层及倒数第三层最多容纳电子数的解释 作者:胡长胜 来源:未知 日期:2018-07-17 13:18:29 点击:12233 所属专题:核外电子排布 最外层电子
1.依据 构造原理中的排布顺序,其实质是各能级的能量高低顺序,可由公式得出 n s( n -2)f( n -1)d n p。 2.解释 (1)最外层由 n s、 n p组成,电子数不大于2+6=8。 (2)次外层由( n -1)s( n -1)p( n -1)d组成,所容纳的电子数不大于2+6+10=18。 (3)倒数第三层...
 [注解与辨疑d] 为什么原子的基态是稳定的? 作者:王世坤 来源:未知 日期:2016-01-30 12:16:37 点击:3542 所属专题:基态 稳定性
[注解与辨疑d] 为什么原子的基态是稳定的? 作者:王世坤 来源:未知 日期:2016-01-30 12:16:37 点击:3542 所属专题:基态 稳定性
基态原子是指原子的核外电子处于能量最低的原子轨道中运动,这种状态的原子,电子离核的距离最小,受原子核的引力最大,所以基态原子是稳定的。原子中的核外电子是不会被吸入原子核的,这是因为在确定轨道中运动的电子,它的能量不会发生改变,电子运动的离心力和原子核的引力...
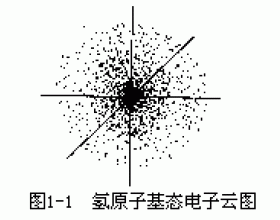 [注解与辨疑d] 核外电子的运动状态 作者:吴键 来源:未知 日期:2021-12-17 09:16:01 点击:38442 所属专题:核外电子运动状态
[注解与辨疑d] 核外电子的运动状态 作者:吴键 来源:未知 日期:2021-12-17 09:16:01 点击:38442 所属专题:核外电子运动状态
电子是质量极轻、体积极...
1.元素的分区和族 1) s 区: , 最后的电子填在 ns 上, 包括 IAIIA, 属于活泼金属, 为碱金属和碱土金属; 2) p区: , 最后的电子填在np上, 包括 IIIA-VIIA以及 0族元素, 为非金属和少数金属; 3) d区: , 最后的电子填在(n-1)d上, 包括 IIIB-VIIB以及VIII族元素, 为过渡金属; ...
1. 排布原则 1) 能量最低原理 电子由能量低的轨道向能量高的轨道排布(电子先填充能量低的轨道,后填充能量高的轨道. 2) Pauli(保利)不相容原理 每个原子轨道中只能容纳两个自旋方向相反的电子(即同一原子中没有运动状态完全相同的电子,亦即无四个量子数完全相同的电子). ...
 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。电离能和电子亲和能都是研究元素游离态的原子的性质。电离能是衡量元素金属性大小的物...
硼,元素符号B,价电子构型2s 2 2p 1 ,第二周期第ⅢA族。 作为非金属,最高氧化数对...
多电子原子中,在考虑某个电子时,可以把其他电子对其排斥作用看作削弱了原子核对它的...
1.核外电子共有几个能层? 能层电子层,根据离原子核远近的不同,由里向外可分为第一、二...
1.一个电子的运动状态要从哪几个方面描述? 答:应从这个电子所处的能层(电子层)是第...
...
基态和激发态 什么是光谱? 光谱:不同元素的原子发生跃迁时会 吸收 ( 基态→激发态 ...
鲍林的能级图只是个近似的能级图,是帮助我们理解电子的填充过程。 但电子填充后轨道...