
|
学习小专题 |

|
学习小专题 |
 [探讨与扩展j] Kw为什么只适合稀溶液? 作者:王欣华 来源:未知 日期:2018-07-19 17:04:34 点击:3725 所属专题:水的离子积常数
[探讨与扩展j] Kw为什么只适合稀溶液? 作者:王欣华 来源:未知 日期:2018-07-19 17:04:34 点击:3725 所属专题:水的离子积常数
【一般情况】 水是一种极弱的电解质,可以发生微弱的电离,其电离方程式为:H 2 O+H 2 O≒H 3 O + + OH - ,简写为H 2 O≒H + + OH - ,是一个吸热过程.水的电离是水分子与水分子之间的相互作用而引起的,因此极难发生,大约55.5×10 8 个水分子中只有1个水分子...
 [探讨与扩展j] 自耦电离:碳酸氢钠能和氯化钙反应分析 作者:康建峰 来源:未知 日期:2021-11-29 19:38:32 点击:6450 所属专题:自偶电离 碳酸氢钠01
[探讨与扩展j] 自耦电离:碳酸氢钠能和氯化钙反应分析 作者:康建峰 来源:未知 日期:2021-11-29 19:38:32 点击:6450 所属专题:自偶电离 碳酸氢钠01
碳酸氢钠能和氯化钙反应的道理可以用碳酸氢根离子的“自偶”电离来解释以上现象;碳酸氢根离子的“自偶”电离解释,很好理解。是的,对学生来说,很难,没有足够的信息,难以书写有关化学用语。...
 [探讨与扩展j] 某些水解为什么能“进行到底” 作者:袁建标 来源: 日期:2015-06-09 22:43:30 点击:3129 所属专题:双水解反应
[探讨与扩展j] 某些水解为什么能“进行到底” 作者:袁建标 来源: 日期:2015-06-09 22:43:30 点击:3129 所属专题:双水解反应
一.水解平衡常数小,无法进行到底 例1.关于醋酸铵溶液——不能进行到底 Ac - + H 2 O = HAc + OH - NH 4 + + H 2 O = NH 3 ·H 2 O + H + 由于生成的H + 和OH - 会结合生成水,所以促进醋酸铵的水解,两式相加得醋酸铵总的水解方程: Ac - + NH 4 + + H...
 [探讨与扩展j] 等浓度、等体积的HA与NaA混合,溶液一定显酸性吗? 作者:陈爱玉 来源: 日期:2015-05-26 19:12:17 点击:1652 所属专题:酸碱性
[探讨与扩展j] 等浓度、等体积的HA与NaA混合,溶液一定显酸性吗? 作者:陈爱玉 来源: 日期:2015-05-26 19:12:17 点击:1652 所属专题:酸碱性
1.若HA为强酸,则等浓度、等体积的HA与NaA混合当然为酸性。 2.若HA为弱酸酸,则等浓度、等体积的HA与NaA混合可能为酸性,可能为碱性,理论上说,也可以为中性。 假设浓度为c mol/L的HA和NaA等体积混合,其中HA的电离常数为K,若混合后溶液为酸性,则必须满足以下关系: c...
 [探讨与扩展j] 同离子效应和盐效应 作者:秦文鑫 来源:未知 日期:2015-02-02 22:48:34 点击:11662 所属专题:同离子效应 盐效应
[探讨与扩展j] 同离子效应和盐效应 作者:秦文鑫 来源:未知 日期:2015-02-02 22:48:34 点击:11662 所属专题:同离子效应 盐效应
一.同离子效应 离子浓度的改变,对弱酸、弱碱电离程度的影响极为显著。 例如在氨水中,加入一些NH 4 Ac时,由于NH 4 Ac是强电解质,它们在溶液中完全电离,这样,溶液中 NH 4 + 离子浓度就会大大增加。使NH 3 +H 2 O NH 4 + + OH - 电离平衡向左移动,从而降低了氨水的...
 [探讨与扩展j] 酸性及碱性的缓冲溶液的PH计算 作者:朱照鹰 来源:未知 日期:2015-01-28 21:04:23 点击:7462 所属专题:缓冲溶液 ph计算
[探讨与扩展j] 酸性及碱性的缓冲溶液的PH计算 作者:朱照鹰 来源:未知 日期:2015-01-28 21:04:23 点击:7462 所属专题:缓冲溶液 ph计算
1.已知25℃时,CH 3 COOH的电离常数为1.8×10 -5 。 则25℃时,0.1mol/L 的CH 3 COOH和0.1mol/L 的CH 3 COONa按体积比1:1混合后,所得混合液的pH是多少?请计算说明。 2.已知25℃时,NH 3 ·H 2 O的电离常数为1.8×10 -5 。 则25℃时,0.1mol/L 的氨水和0.1mol/L 的NH 4 C...
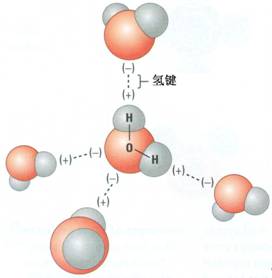 [探讨与扩展j] 常用的酸碱理论 作者:樊会武 来源:未知 日期:2014-10-15 17:09:39 点击:6432 所属专题:酸碱理论
[探讨与扩展j] 常用的酸碱理论 作者:樊会武 来源:未知 日期:2014-10-15 17:09:39 点击:6432 所属专题:酸碱理论
1.Arrhenius理论,----------“酸碱电离理论” 定义:凡是水溶液中产生H + 离子的物质就叫酸,产生OH - 离子的就叫碱。 重要性及优点:是建立在电离理论之上,大众最熟知的经典酸碱理论。建立了对酸碱强度的定量描述;适用于pH计算、电离度计算、缓冲溶液计算、溶解度计算...
 [探讨与扩展j] 为什么有的弱电解质电离时是放热的? 作者:陈女婷 来源:未知 日期:2018-07-19 16:36:22 点击:4827 所属专题:弱电解质 电解质电离
[探讨与扩展j] 为什么有的弱电解质电离时是放热的? 作者:陈女婷 来源:未知 日期:2018-07-19 16:36:22 点击:4827 所属专题:弱电解质 电解质电离
为什么有的弱电解质电离时是放热的。例如,1 mol氢氟酸电离时放出10.4 kJ/mol热量。当它跟1 mol NaOH溶液反应时,中和热是67.7 kJ/mol。 离子水合时,由于离子与水分子的电子层有斥力,所以放出能量就能减少斥力,从而使水合离子趋于稳定,HF在水中的电离比一般弱电解质...
 [探讨与扩展j] NaHCO3溶液中碳酸根离子一定小于氢氧根离子吗 作者:罗成 来源:未知 日期:2013-11-14 16:02:24 点击:5590 所属专题:碳酸氢钠01 离子浓度大小比较
[探讨与扩展j] NaHCO3溶液中碳酸根离子一定小于氢氧根离子吗 作者:罗成 来源:未知 日期:2013-11-14 16:02:24 点击:5590 所属专题:碳酸氢钠01 离子浓度大小比较
1 问题的提出 在高中化学教学中,溶液中离子浓度大小的比较是一个重要的知识点。有关 NaHCO 3 溶液中各种离子浓度大小比较的问题,经常出现在各种教辅资料的习题和考题中。一般都认为 [OH - ][CO 3 2- ] 。常见的分析思路是 NaHCO 3 溶液中存在着如下平衡: H 2 O 的电离 :...
 [探讨与扩展j] 比较NaHCO3溶液中各离子浓度的大小 作者:徐志宏 来源:未知 日期:2013-03-06 10:42:49 点击:9697 所属专题:碳酸氢钠01 离子浓度大小比较
[探讨与扩展j] 比较NaHCO3溶液中各离子浓度的大小 作者:徐志宏 来源:未知 日期:2013-03-06 10:42:49 点击:9697 所属专题:碳酸氢钠01 离子浓度大小比较
一、比较 [H + ] 与[ OH - ]的大小 在NaHCO 3 溶液中存在如下平衡: H 2 O电离:H 2 O H + +OH - K w =1.0×10 - 14 HCO 3 - 的电离:HCO 3 - H + +CO 3 2 - Ka 2 =5.6×10 - 11 HCO 3 - 的水解:HCO 3 - +H 2 O H 2 CO 3 +OH - K h ==K w /Ka 1 =2.4×10...
 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。...
什么是PH?PH是拉丁文“Pondushydrogenii”一词的缩写(Pondus=压强、压力hydrogenium=...
一、水的离子积计算 水的离子积( K w )是一个使用频率较高的化学数据。而一个电极反应...
多元弱酸在水中是分步电离的,因此,计算时应考虑电离 / 反应程度。 向 0.10mol/L 草...
强酸溶液氢离子浓度: HCl 溶液中,完全电离,因此 [H + ]=[ Cl - ] =[H Cl ] 弱酸 溶...
我们接触到的溶剂大部分是水,因而把能够在电离产生水中阳离子(H 3 O + )的物质叫...
碳酸氢钠能和氯化钙反应的道理可以用碳酸氢根离子的“自偶”电离来解释以上现象;碳酸...
有关自偶电离特别是非水溶剂中自偶电离的试题不断涌现,逐渐成为了各类考试特别是高中...