
|
学习小专题 |

|
学习小专题 |
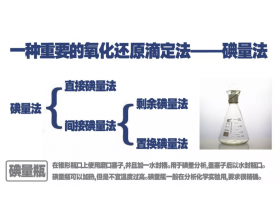 [方法与规律j] 碘量法的原理与应用 作者:淮畔化学 来源:未知 日期:2019-05-13 09:20:47 点击:17193 所属专题:碘量法 滴定法
[方法与规律j] 碘量法的原理与应用 作者:淮畔化学 来源:未知 日期:2019-05-13 09:20:47 点击:17193 所属专题:碘量法 滴定法
一、碘量法的基本原理 1、直接碘量法 直接碘量法是用碘滴定液直接滴定还原性物质的方法。在滴定过程中,I2被还原为I-: 直接碘量法只能在酸性、中性或弱碱性溶液中进行,如果溶液pH>9,可发生副反应使测定结果不准确。 直接碘量法可用淀粉指示剂指示终点。淀粉遇碘显蓝...
 [方法与规律j] 利用酸轴分析化学反应规律 作者:张劲辉 来源:未知 日期:2019-01-08 15:58:08 点击:1164 所属专题:化学反应规律 强酸制弱酸
[方法与规律j] 利用酸轴分析化学反应规律 作者:张劲辉 来源:未知 日期:2019-01-08 15:58:08 点击:1164 所属专题:化学反应规律 强酸制弱酸
铝轴:H + —Al 3+ —Al(OH) 3 —Al O 2 - —OH - 硫轴:H 2 S—S—SO 2 ——H 2 SO 4 酸轴:H + —CH 3 COOH—H 2 CO 3 —(HClO)C 6 H 5 OH— (CH 3 COO - )HC O 3 - —(ClO - )C 6 H 5 O - —C O 3 2 - —OH - 相邻没戏。比如Al O 2 - 与OH - 、SO 2 与H 2 S...
 [方法与规律j] 双水解反应简捷配平法 作者:化学自习室 来源:未知 日期:2018-08-04 16:57:19 点击:2032 所属专题:双水解反应
[方法与规律j] 双水解反应简捷配平法 作者:化学自习室 来源:未知 日期:2018-08-04 16:57:19 点击:2032 所属专题:双水解反应
谁弱选谁切记清,添加系数电何等。 反应式中常加水, 质量守恒即配平。 说明:双水解反应,是指由一种强酸弱碱盐与另一种强碱弱酸盐作用,由于相互促进,从而使水解反应进行到底的反应。如:Al 2 (SO 4 ) 3 和Na 2 CO 3 反应。该法的特点是可以直接写系数, 可在瞬间完成配...
 [方法与规律j] 强酸制弱酸信息题的应对策略 作者:胡建树 来源:未知 日期:2017-09-14 09:23:47 点击:1273 所属专题:强酸制弱酸 陌生方程式
[方法与规律j] 强酸制弱酸信息题的应对策略 作者:胡建树 来源:未知 日期:2017-09-14 09:23:47 点击:1273 所属专题:强酸制弱酸 陌生方程式
...
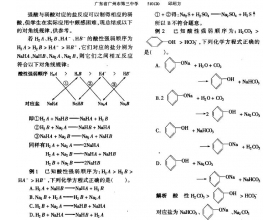 [方法与规律j] 强酸制弱酸的对角线规律(强烈推荐) 作者:邱绍方 来源:未知 日期:2017-09-11 17:08:24 点击:4573 所属专题:强酸制弱酸
[方法与规律j] 强酸制弱酸的对角线规律(强烈推荐) 作者:邱绍方 来源:未知 日期:2017-09-11 17:08:24 点击:4573 所属专题:强酸制弱酸
...
 [方法与规律j] 如何写化学中三大守恒式(电荷守恒,物料守恒,质子守恒) 作者:林飞 来源:未知 日期:2020-03-03 11:44:26 点击:11319 所属专题:电荷守恒 物料守恒 质子守恒 三大守恒
[方法与规律j] 如何写化学中三大守恒式(电荷守恒,物料守恒,质子守恒) 作者:林飞 来源:未知 日期:2020-03-03 11:44:26 点击:11319 所属专题:电荷守恒 物料守恒 质子守恒 三大守恒
这三个守恒的最大应用是判断溶液中粒子浓度的大小,或它们之间的关系等式。 电荷守恒--即溶液永远是电中性的,所以阳离子带的正电荷总量=阴离子带的负电荷总量 例: NH 4 Cl溶液 c ( NH 4 + )+ c (H + )= c (Cl - )+ c (OH - ) 写这个等式要注意2点: 1、要判...
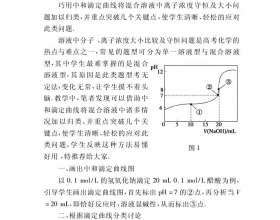 [方法与规律j] 巧用中和滴定曲线解决混合溶液中离子浓度守恒及大小问题 作者:田兴虎 来源:未知 日期:2020-03-03 11:48:19 点击:1761 所属专题:中和滴定曲线 三大守恒
[方法与规律j] 巧用中和滴定曲线解决混合溶液中离子浓度守恒及大小问题 作者:田兴虎 来源:未知 日期:2020-03-03 11:48:19 点击:1761 所属专题:中和滴定曲线 三大守恒
...
近年高考频繁出现酸碱中和滴定的图象题,此类题试题综合性强,难度较大,不仅考查学生定性与定量结合分析问题的思想,而且考查学生数形结合识图用图的能力,还要求学生能深入微观世界认识各种化学过程来解决比较微粒浓度大小问题。但万变不离其中,离不开指示剂的选择,...
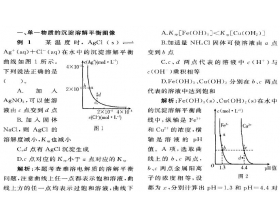 [方法与规律j] 探究高中化学沉淀溶解平衡图像的解题策略 作者:汪军 来源:未知 日期:2020-01-31 12:00:28 点击:2082 所属专题:溶解平衡图像 溶度积曲线
[方法与规律j] 探究高中化学沉淀溶解平衡图像的解题策略 作者:汪军 来源:未知 日期:2020-01-31 12:00:28 点击:2082 所属专题:溶解平衡图像 溶度积曲线
...
 [方法与规律j] 高频考查的四类离子平衡图像 作者:秦文鑫 来源:未知 日期:2020-02-01 17:06:53 点击:1447 所属专题:电解质溶液图像
[方法与规律j] 高频考查的四类离子平衡图像 作者:秦文鑫 来源:未知 日期:2020-02-01 17:06:53 点击:1447 所属专题:电解质溶液图像
...
 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。双指示剂法是一种利用两种具有不同变色范围的酸碱指示剂,在滴定过程中分别指示两个不...
弱酸也可以制备强酸!!! 比如向 CuSO 4 溶液中加入 H 2 S 溶液生成 CuS 黑色沉淀和 ...
氧化还原滴定法: 1.特点: 氧化还原滴定法在药物分析中应用广泛,用于测定具有氧化性...
问题1: 在酸溶液中,H + 和OH - 的来源分别是什么?举例说明怎样计算由水电离产生...
电离平衡常数是高考中一个重要的必考考点,常考查电离平衡常数的计算、弱酸的相对强弱...
...
一、原理:影响水的电离平衡因素 H 2 O H + +OH - 1.25 ℃, → c (H + ) H2O = ...
...