
|
学习小专题 |

|
学习小专题 |
 [注解与辨疑j] 由于双水解在溶液中不能大量共存的离子组总结 作者:张澳 来源:未知 日期:2016-02-02 20:17:51 点击:7702 所属专题:双水解反应 离子共存
[注解与辨疑j] 由于双水解在溶液中不能大量共存的离子组总结 作者:张澳 来源:未知 日期:2016-02-02 20:17:51 点击:7702 所属专题:双水解反应 离子共存
弱酸根离子与弱碱阳离子在水溶液中 不能 大量 共存 的情况常见的有:...
 [有机化学] 水解反应面面观 作者:周广 来源:未知 日期:2016-01-08 22:24:24 点击:11624 所属专题:水解反应 有机反应
[有机化学] 水解反应面面观 作者:周广 来源:未知 日期:2016-01-08 22:24:24 点击:11624 所属专题:水解反应 有机反应
所谓水解反应,即物质跟水发生的相互变换成分的反应.用通式可表示为: 反应的机理可简单地认为是:共价键(X—Y键、H—O键)断裂(一般地,一个水分于中只有一个H—O键断裂),再按异电相吸原则,重新组合成新键即得产物.至于离子键则视为共价键的极限情形.各类水解...
 [注解与辨疑j] 酸式盐水溶液的酸碱性概括小结 作者:徐志宏 来源:未知 日期:2012-05-16 09:43:40 点击:7919 所属专题:酸式盐 酸碱性判断
[注解与辨疑j] 酸式盐水溶液的酸碱性概括小结 作者:徐志宏 来源:未知 日期:2012-05-16 09:43:40 点击:7919 所属专题:酸式盐 酸碱性判断
(1)强碱强酸酸式盐 由于在水溶液中只能进一步电离出H + ,不会发生水解,所以只具备酸性,可代替一元强酸使用,如: NaHSO 4 +NaHCO 3 =Na 2 SO 4 +H 2 O+CO 2 ↑ NaHSO 4 +NaCl Na 2 SO 4 +HCl↑ (2)强碱弱酸酸式盐 由于强碱弱酸酸式盐中含有弱酸酸式根,既可以进一步...
 [注解与辨疑j] FeCl3溶液与Na2S溶液反应生成什么? 作者:张劲辉 来源:未知 日期:2012-05-16 09:22:31 点击:9597 所属专题:氯化铁 双水解反应
[注解与辨疑j] FeCl3溶液与Na2S溶液反应生成什么? 作者:张劲辉 来源:未知 日期:2012-05-16 09:22:31 点击:9597 所属专题:氯化铁 双水解反应
问:“在FeCl 3 溶液中加入Na 2 S溶液发生的反应有两种说法,一是: 2Fe 3+ +S 2- =2Fe 2+ +S↓; 又一为: 2Fe 3+ +3S 2- +6H 2 O=2Fe(OH) 3 ↓+3H 2 S↑ 这两种说法哪个正确? 答:一般说来,Fe 3+ 具有较强的氧化性,而S 2- 则具有还原性,因此当Fe 3+ 与S 2- 相遇时,Fe...
 [注解与辨疑j] 影响电离度的因素 作者:吴传鹏 来源:未知 日期:2012-05-16 09:19:41 点击:12063 所属专题:电离度 电离平衡
[注解与辨疑j] 影响电离度的因素 作者:吴传鹏 来源:未知 日期:2012-05-16 09:19:41 点击:12063 所属专题:电离度 电离平衡
①电解质的结构 具有离子键或强极性的分子在水溶液中的电离度均很大,几乎是100%。弱极性或非极性分子在水中呈微弱电离甚至不电离。电解质中键的极性越大,其电离度也越大。离子化合物的电离度取决于离子电荷及离子半径。离子电荷越高,半径越小,则其电离度越...
 [注解与辨疑j] 电离常数和电离度有什么关系? 作者:羊绍敬 来源:未知 日期:2012-05-16 08:41:29 点击:39628 所属专题:电离平衡常数 电离度
[注解与辨疑j] 电离常数和电离度有什么关系? 作者:羊绍敬 来源:未知 日期:2012-05-16 08:41:29 点击:39628 所属专题:电离平衡常数 电离度
(1)弱电解质的电离是一种可逆过程。以醋酸的电离为例,醋酸溶于水后,它的分子即电离为H+离子和CH 3 COO - 离子,这是正过程,同时逆过程是H + 离子和CH 3 COO - 离子重新结合成醋酸分子。 CH 3 COOH H + +CH 3 COO - 在这个过程中,CH 3 COOH分子电离的速率(正反应的速率)...
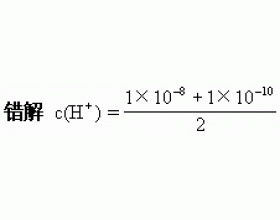 [注解与辨疑j] pH拾零 作者:潘祥泰 来源:未知 日期:2016-02-02 19:49:52 点击:9024 所属专题:ph值 ph计算
[注解与辨疑j] pH拾零 作者:潘祥泰 来源:未知 日期:2016-02-02 19:49:52 点击:9024 所属专题:ph值 ph计算
一、pH与酸碱性 1.溶液酸碱性的强弱由pH决定,与温度、溶质无关。如:pH均为2的硫酸溶液与醋酸溶液酸度相同。 2.pH等于7的溶液不一定呈中性。(“pH=7为中性”习惯上指常温时) 二、 pH的计算 1.计算时先确定溶液的酸碱性,计算顺序为:酸性→c(H + )→pH;碱性→c(O...
 [注解与辨疑j] 为什么要引入“pH” 作者:罗翊轩 来源:未知 日期:2016-03-09 21:47:08 点击:3133 所属专题:ph值
[注解与辨疑j] 为什么要引入“pH” 作者:罗翊轩 来源:未知 日期:2016-03-09 21:47:08 点击:3133 所属专题:ph值
溶液的酸碱度,可用[H + ]或[OH - ]表示。但我们常碰到的某些溶液的酸度或碱度很...
 [注解与辨疑j] 小议强酸和弱酸的区别 作者:熊振典 来源:未知 日期:2012-05-15 18:31:07 点击:7278 所属专题:强酸与弱酸比较
[注解与辨疑j] 小议强酸和弱酸的区别 作者:熊振典 来源:未知 日期:2012-05-15 18:31:07 点击:7278 所属专题:强酸与弱酸比较
1强酸在水溶液中全部电离,不存在溶质分子;弱酸在水溶液中部分电离,因存在电离平衡,所以既含溶质离子,又含溶质分子. 2 pH相同的强酸和弱酸,弱酸的物质的量浓度大于强酸的. 3同温度、同浓度的强酸溶液的导电性强于弱酸溶液的. 4中和同体积、同pH的强酸和弱酸,弱酸的...
 [注解与辨疑j] 纯水的电离度是多大? 作者:刘学超 来源:未知 日期:2012-05-15 18:26:17 点击:7709 所属专题:水的电离 电离度
[注解与辨疑j] 纯水的电离度是多大? 作者:刘学超 来源:未知 日期:2012-05-15 18:26:17 点击:7709 所属专题:水的电离 电离度
生活中,我们一般会认为纯水是不导电的。但根据精确的实验证明,水是一种极弱的电解质,它能微弱地电离,生成水合氢离子和氢氧根离子。其电离方程式可表示为: H 2 O+H 2 O H 3 O + +OH - 可简写为:H 2 O H + +OH - ,从纯水的导电实验测得,在25℃(常温)时,纯水中H + 和...
 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。为什么NaHCO 3 溶液能与Na[Al(OH) 4 ]溶液反应? NaHSO 3 溶液之所以能与Na[Al(OH) 4 ...
双水解程度计算: 同样是双水解,为什么CH 3 COO - 和 NH 4 + 可以大量共存,而Al 3...
我们在看到酸碱中和滴定图像时,看到反应一半点处图像很平缓,这是因为这一部分成分构...
请教:恒温下向CH 3 COONa稀溶液中加入少量固体醋酸钠 c (CH 3 COO - )/ c (Na + )...
热冰,一个看似矛盾却又真实存在的物质,打破了我们对冰与热的传统认知。它是一种在高...
1、 碳酸氢钠溶液pH计算公式的推导 注意: 值得注意的是,最后推导的公式从表面上看c(...
溶解度和溶度积换算 溶解度和溶度积均可以定量表示难溶物质的溶解性。 溶解度与溶度积...
...