
|
学习小专题 |

|
学习小专题 |
 [注解与辨疑j] 同离子效应与盐效应 作者:翟娜 来源:未知 日期:2013-04-11 10:34:05 点击:11135 所属专题:同离子效应 盐效应
[注解与辨疑j] 同离子效应与盐效应 作者:翟娜 来源:未知 日期:2013-04-11 10:34:05 点击:11135 所属专题:同离子效应 盐效应
若在难溶电解质溶液中,加入一种与难溶电解质无共同离子的电解质,将使难溶电解质的溶解度增大。这种由于加入了易溶的强电解质而增大难溶电解质溶解度的现象称作盐效应。例如BaSO 在KNO 溶液中的溶解度就比在纯水中稍大,并且KNO 浓度越大,BaSO 的溶解度也变得越大。这...
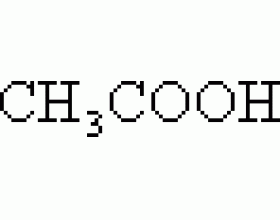 [注解与辨疑j] 电离度解析 作者:刘学超 来源:未知 日期:2013-04-10 08:32:20 点击:5117 所属专题:电离度
[注解与辨疑j] 电离度解析 作者:刘学超 来源:未知 日期:2013-04-10 08:32:20 点击:5117 所属专题:电离度
弱酸、弱碱等弱电解质在水溶液中存在电离平衡。例如: 当达到电离平衡时,弱电解质溶液里的离子浓度保持一定,可用此时离子浓度的高低衡量弱电解质的相对强弱。本节的电离度就是定量描述弱电解质强弱的重要概念。 1 .准确理解电离度的概念 当弱电解质在溶液里达到电离平衡...
 [注解与辨疑j] Ksp中s及p的含义 作者:张澳 来源:未知 日期:2013-03-28 09:10:28 点击:4690 所属专题:溶度积
[注解与辨疑j] Ksp中s及p的含义 作者:张澳 来源:未知 日期:2013-03-28 09:10:28 点击:4690 所属专题:溶度积
Ksp中sp即solubility product,solubility(可溶物),product(乘积),solubility product(溶度积)。类似的Kw中的w是water(水)。...
 [注解与辨疑j] 应用盐类水解知识解释的几个问题 作者:张扬 来源:未知 日期:2020-01-30 14:08:15 点击:8031 所属专题:盐类水解应用
[注解与辨疑j] 应用盐类水解知识解释的几个问题 作者:张扬 来源:未知 日期:2020-01-30 14:08:15 点击:8031 所属专题:盐类水解应用
1 . 化学实验中的盐类水解问题 ⑴ 为什么实验室中配制 FeCl 3 溶液时要在其中加入少量浓盐酸? 目的是为了防止 FeCl3 溶液的水解,因为在 FeCl3 溶液中存在下列水解方程式, FeCl 3 + 3H 2 O Fe(OH) 3 ↓+ 3HCl,当在溶液中加入浓盐酸时,该水解方程式向左进行,从而...
 [注解与辨疑j] 室温与常温分别是多少? 作者:赵亭 来源:未知 日期:2020-02-26 10:32:59 点击:17567 所属专题:室温与常温
[注解与辨疑j] 室温与常温分别是多少? 作者:赵亭 来源:未知 日期:2020-02-26 10:32:59 点击:17567 所属专题:室温与常温
我国定义室温为25℃,常温为20℃。 国际上一般认定室温和常温都为20℃ “常温”出现的场合分为不同领域,日常之中,比如物品保存问题等。在技术领域,不同纬度国家或地区有类似国家标准的常温规定,举例如下: 北欧:15℃......瑞典、芬兰、挪威、荷兰 欧洲:20℃.........
 [注解与辨疑j] NaHCO3的碱性比NaAc强吗? 作者:张玮 来源:未知 日期:2013-03-12 15:34:25 点击:3051 所属专题:碳酸氢钠01 酸碱性判断
[注解与辨疑j] NaHCO3的碱性比NaAc强吗? 作者:张玮 来源:未知 日期:2013-03-12 15:34:25 点击:3051 所属专题:碳酸氢钠01 酸碱性判断
经常听到老师给学生讲解: H 2 CO 3 的酸性比 HAc 弱,所以对应 NaHCO 3 的碱性比 NaAc 强。这当然是错误的,事实上 NaHCO 3 溶液的 pH 约为 8.3 ,而 0.1mol/L NaAc 溶液的 pH 为 8.9 , 0.01mol/L NaAc 溶液的 pH 约为 8.4 。 问题在于 NaHCO 3 是酸式盐,其水解度可能高...
 [探讨与扩展3] 弱碱阳离子与弱酸根一定不能大量共存吗? 作者:万胜 来源:未知 日期:2013-03-07 10:43:29 点击:4617 所属专题:离子共存 双水解反应
[探讨与扩展3] 弱碱阳离子与弱酸根一定不能大量共存吗? 作者:万胜 来源:未知 日期:2013-03-07 10:43:29 点击:4617 所属专题:离子共存 双水解反应
分析:弱碱阳离子与弱酸很能不能大量共存,不能一概而论。而在中学不少资料上的离子能否共存习题中都认为:弱碱阳离子与弱酸根不能大量共存,这是错误的。如醋酸铵、碳酸氢铵等就是弱碱阳离子与弱酸根可以大量共存的例子。而有些弱碱阳离子与弱酸根互促水解程度大,甚至...
 [探讨与扩展3] 复分解反应条件之一是生成难溶物质吗? 作者:潘祥泰 来源:未知 日期:2013-03-07 10:30:25 点击:2915 所属专题:复分解反应
[探讨与扩展3] 复分解反应条件之一是生成难溶物质吗? 作者:潘祥泰 来源:未知 日期:2013-03-07 10:30:25 点击:2915 所属专题:复分解反应
分析: 新、旧教材在阐述复分解反应的条件时都是这样阐述的,其实这会给学生带来负面影响,不少学生甚至认为只有生成难溶物质才会有沉淀。其实只要溶质的量超过溶解度所允许值,不论难溶物质还是易溶物质都能沉淀,反应也就因此而发生了(学生往往把生成沉淀和析出晶体割离...
 [注解与辨疑j] 有关物理量的上下标规范问题 作者:范瑞开 来源:未知 日期:2013-02-28 16:22:46 点击:3645 所属专题:规范
[注解与辨疑j] 有关物理量的上下标规范问题 作者:范瑞开 来源:未知 日期:2013-02-28 16:22:46 点击:3645 所属专题:规范
K c (或K p ) 中 c 、 p 分别 表示浓度和压强,要斜体;而 K a 、 K b 、 K w 、 K sp 中 a 、 b 、 w 、 sp 均不用斜体; Δ G m θ ( T ) 中 G 、 T 为斜体,而 m 、 θ 不用斜体 ; Δ H m θ ( T ) 中 H 、 T 为斜体,而 m 、 θ 不用斜体 。...
 [注解与辨疑j] 某盐溶液显中性,该盐一定未水解吗? 作者:孙禹 来源:未知 日期:2012-11-07 09:41:39 点击:4050 所属专题:盐类水解规律
[注解与辨疑j] 某盐溶液显中性,该盐一定未水解吗? 作者:孙禹 来源:未知 日期:2012-11-07 09:41:39 点击:4050 所属专题:盐类水解规律
某盐溶液显中性,该盐不一定未水解,例如:NaCl溶液显中性,是因为NaCl是强酸强碱盐,不水解。再例如:CH 3 COONH 4 溶液显中性,却是水解的结果。 CH 3 COONH 4 是易溶、易电离的弱酸弱碱盐,根据盐类水解的原理及实质来看,CH 3 COONH 4 确实能水解,CH 3 COO - 水解生成C...
 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。为什么NaHCO 3 溶液能与Na[Al(OH) 4 ]溶液反应? NaHSO 3 溶液之所以能与Na[Al(OH) 4 ...
双水解程度计算: 同样是双水解,为什么CH 3 COO - 和 NH 4 + 可以大量共存,而Al 3...
我们在看到酸碱中和滴定图像时,看到反应一半点处图像很平缓,这是因为这一部分成分构...
请教:恒温下向CH 3 COONa稀溶液中加入少量固体醋酸钠 c (CH 3 COO - )/ c (Na + )...
热冰,一个看似矛盾却又真实存在的物质,打破了我们对冰与热的传统认知。它是一种在高...
1、 碳酸氢钠溶液pH计算公式的推导 注意: 值得注意的是,最后推导的公式从表面上看c(...
溶解度和溶度积换算 溶解度和溶度积均可以定量表示难溶物质的溶解性。 溶解度与溶度积...
...