
|
学习小专题 |

|
学习小专题 |
 [注解与辨疑j] 影响电离度的因素 作者:吴传鹏 来源:未知 日期:2012-05-16 09:19:41 点击:12029 所属专题:电离度 电离平衡
[注解与辨疑j] 影响电离度的因素 作者:吴传鹏 来源:未知 日期:2012-05-16 09:19:41 点击:12029 所属专题:电离度 电离平衡
①电解质的结构 具有离子键或强极性的分子在水溶液中的电离度均很大,几乎是100%。弱极性或非极性分子在水中呈微弱电离甚至不电离。电解质中键的极性越大,其电离度也越大。离子化合物的电离度取决于离子电荷及离子半径。离子电荷越高,半径越小,则其电离度越...
 [注解与辨疑j] 电离常数和电离度有什么关系? 作者:羊绍敬 来源:未知 日期:2012-05-16 08:41:29 点击:39372 所属专题:电离平衡常数 电离度
[注解与辨疑j] 电离常数和电离度有什么关系? 作者:羊绍敬 来源:未知 日期:2012-05-16 08:41:29 点击:39372 所属专题:电离平衡常数 电离度
(1)弱电解质的电离是一种可逆过程。以醋酸的电离为例,醋酸溶于水后,它的分子即电离为H+离子和CH 3 COO - 离子,这是正过程,同时逆过程是H + 离子和CH 3 COO - 离子重新结合成醋酸分子。 CH 3 COOH H + +CH 3 COO - 在这个过程中,CH 3 COOH分子电离的速率(正反应的速率)...
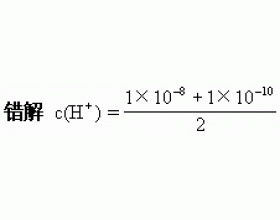 [注解与辨疑j] pH拾零 作者:潘祥泰 来源:未知 日期:2016-02-02 19:49:52 点击:9015 所属专题:ph值 ph计算
[注解与辨疑j] pH拾零 作者:潘祥泰 来源:未知 日期:2016-02-02 19:49:52 点击:9015 所属专题:ph值 ph计算
一、pH与酸碱性 1.溶液酸碱性的强弱由pH决定,与温度、溶质无关。如:pH均为2的硫酸溶液与醋酸溶液酸度相同。 2.pH等于7的溶液不一定呈中性。(“pH=7为中性”习惯上指常温时) 二、 pH的计算 1.计算时先确定溶液的酸碱性,计算顺序为:酸性→c(H + )→pH;碱性→c(O...
 [注解与辨疑j] 为什么要引入“pH” 作者:罗翊轩 来源:未知 日期:2016-03-09 21:47:08 点击:3123 所属专题:ph值
[注解与辨疑j] 为什么要引入“pH” 作者:罗翊轩 来源:未知 日期:2016-03-09 21:47:08 点击:3123 所属专题:ph值
溶液的酸碱度,可用[H + ]或[OH - ]表示。但我们常碰到的某些溶液的酸度或碱度很...
 [注解与辨疑j] 小议强酸和弱酸的区别 作者:熊振典 来源:未知 日期:2012-05-15 18:31:07 点击:7254 所属专题:强酸与弱酸比较
[注解与辨疑j] 小议强酸和弱酸的区别 作者:熊振典 来源:未知 日期:2012-05-15 18:31:07 点击:7254 所属专题:强酸与弱酸比较
1强酸在水溶液中全部电离,不存在溶质分子;弱酸在水溶液中部分电离,因存在电离平衡,所以既含溶质离子,又含溶质分子. 2 pH相同的强酸和弱酸,弱酸的物质的量浓度大于强酸的. 3同温度、同浓度的强酸溶液的导电性强于弱酸溶液的. 4中和同体积、同pH的强酸和弱酸,弱酸的...
 [注解与辨疑j] 纯水的电离度是多大? 作者:刘学超 来源:未知 日期:2012-05-15 18:26:17 点击:7659 所属专题:水的电离 电离度
[注解与辨疑j] 纯水的电离度是多大? 作者:刘学超 来源:未知 日期:2012-05-15 18:26:17 点击:7659 所属专题:水的电离 电离度
生活中,我们一般会认为纯水是不导电的。但根据精确的实验证明,水是一种极弱的电解质,它能微弱地电离,生成水合氢离子和氢氧根离子。其电离方程式可表示为: H 2 O+H 2 O H 3 O + +OH - 可简写为:H 2 O H + +OH - ,从纯水的导电实验测得,在25℃(常温)时,纯水中H + 和...
 [注解与辨疑j] 酸碱中和反应三种终点的比较 作者:翟娜 来源:未知 日期:2016-02-02 20:25:30 点击:14412 所属专题:中和滴定
[注解与辨疑j] 酸碱中和反应三种终点的比较 作者:翟娜 来源:未知 日期:2016-02-02 20:25:30 点击:14412 所属专题:中和滴定
酸碱中和反应的终点在理论上应是酸碱恰好完全反应的点(即化学反应的计量点)。但在中和滴定实验中,被滴定的溶液通常不发生任何外观变化,需要借助酸碱指示剂的颜色变化来指示滴定的终点。另外有时还会提出中和至中性的点。上述三种终点之间的区别和联系,我们在学习时...
 [注解与辨疑j] 透析电解质中的八大关系 作者:舒龙昌 来源:未知 日期:2016-02-02 20:34:29 点击:31772 所属专题:电解质判断 弱电解质判断
[注解与辨疑j] 透析电解质中的八大关系 作者:舒龙昌 来源:未知 日期:2016-02-02 20:34:29 点击:31772 所属专题:电解质判断 弱电解质判断
一.电解质、非电解质概念间的关系 电解质是指在水溶液中或熔化状态下能够导电的化合物;非电解质是指在水溶液中和熔化状态下都不能够导电的化合物。显然电解质和非电解质是对化合物的一种分类,因此混合物既不是电解质也不是非电解质。此外“不是电解质”与非电解质不...
 [注解与辨疑j] 强电解质和弱电解质怎么分? 作者:黄元 来源:未知 日期:2014-11-25 10:37:37 点击:5030 所属专题:弱电解质判断
[注解与辨疑j] 强电解质和弱电解质怎么分? 作者:黄元 来源:未知 日期:2014-11-25 10:37:37 点击:5030 所属专题:弱电解质判断
在水溶液中全部电离的电解质叫做强电解质,部分电离的电解质叫做弱电解质。 强酸、强碱和绝大多数可溶性的盐在水溶液里都能全部电离,它们都是强电解质。弱酸、弱碱在水溶液里只能部分电离,它们都是弱电解质。 从化合物结构来看,有典型离子键的化合物(如强碱和大部分...
 [注解与辨疑j] 同离子效应 作者:黄元 来源:未知 日期:2016-02-02 20:47:55 点击:8417 所属专题:同离子效应
[注解与辨疑j] 同离子效应 作者:黄元 来源:未知 日期:2016-02-02 20:47:55 点击:8417 所属专题:同离子效应
由于加入含相同离子的强电解质,使弱电解质电离度减小或使难溶盐溶解度降低的效应,叫同离子效应。分别说明如下: ①使弱电解质电离度减小 例如,在醋酸溶液中加人醋酸钠,由于醋酸钠是强电解质、在水中全部电离成Na + 和Ac - ,溶液中Ac - 浓度增大,大量的Ac - 同H + ...
 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。1、 碳酸氢钠溶液pH计算公式的推导 注意: 值得注意的是,最后推导的公式从表面上看c(...
溶解度和溶度积换算 溶解度和溶度积均可以定量表示难溶物质的溶解性。 溶解度与溶度积...
...
酸碱滴定法 强酸滴定强碱的反应 强酸滴定弱碱的反应 混合碱的滴定(双指示剂法+滴定突...
【学生疑问】 教材上有两个实验,一个是 AgI 转化为 Ag 2 S,一个是 Mg(OH) 2 转化为 ...
25 ℃ 时, K a1 (H 2 S)=1.1 × 10 -7 ; K a2 (H 2 S)=1.3 × 10 -13 . (高等教育...
沉淀转化是沉淀溶解平衡的应用之一。 对于溶度积较大的沉淀转为溶度积较小的沉淀这类...
1.实例 常温下,用0.100 0 mol·L -1 NaOH溶液滴定20.00 mL 0.100 0 mol·L -1 CH 3...