
|
学习小专题 |

|
学习小专题 |
 [注解与辨疑a] 关于化学键的注解 作者:彭琳 来源:未知 日期:2012-12-03 10:53:52 点击:10385 所属专题:化学键
[注解与辨疑a] 关于化学键的注解 作者:彭琳 来源:未知 日期:2012-12-03 10:53:52 点击:10385 所属专题:化学键
1.化学键的定义:在分子或晶体中,相邻原子或离子间的强烈的相互作用。 解析:键 本意是指连接门和门框的金属器件(叫做合页或铰链)引申义为结合力。化学键就是化学结合力。 由分子构成的物质,化学键(共价键)存在于分子中;由原子、离子构成的物质,化学键(共价键...
 [注解与辨疑a] 化学键的文化底座在哪里 作者:单莹 来源:未知 日期:2012-12-03 10:54:29 点击:21109 所属专题:化学键
[注解与辨疑a] 化学键的文化底座在哪里 作者:单莹 来源:未知 日期:2012-12-03 10:54:29 点击:21109 所属专题:化学键
上海市化学特级教师郑胤飞今天开了一节《从独占到共享------化学键绪论》,听者颇多感受,受益匪浅。在我的耳朵与心灵被征服的过程中,我的思绪也随着起舞,并飘到了更远的地方。 一、 物理与化学的文化分野在哪里 物理与化学从某种角度来说,都是研究物质与能量的科学...
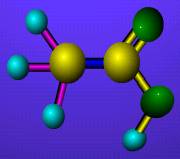 [注解与辨疑a] 分子极性判断的实质 作者:彭琳 来源:未知 日期:2016-01-30 12:50:08 点击:4609 所属专题:分子极性
[注解与辨疑a] 分子极性判断的实质 作者:彭琳 来源:未知 日期:2016-01-30 12:50:08 点击:4609 所属专题:分子极性
原子通过共价键的作用构成分子,构成分子的原子可以是同种类别,也可以是不同类别。 同种原子间形成的共价键是无极性共价键,所以由同种原子构成的分子是非极性分子。 不同种原子间形成的共价键是极性共价键,由于原子对共用电子对地吸引作用的差异,造成此极性共价键的...
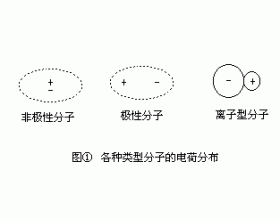 [注解与辨疑a] 极性分子和非极性分子的区别 作者:向小平 来源:未知 日期:2016-01-30 12:50:36 点击:13872 所属专题:分子极性
[注解与辨疑a] 极性分子和非极性分子的区别 作者:向小平 来源:未知 日期:2016-01-30 12:50:36 点击:13872 所属专题:分子极性
在任何一个分子中都可以找到一个正电荷重心和一个负电荷重心,根据正负电荷重心是否重合,可以把分子分为极性分子和非极性分子。如果分子中正电荷的重心与负电荷的重心相重合,那就是非极性分子;如果正负电荷重心不重合,则分子就因显正负两极而形成偶极,这种分子叫做...
 [注解与辨疑a] 元素化合价的递变规律 作者:段文娟 来源:未知 日期:2012-05-12 20:25:07 点击:12535 所属专题:化合价
[注解与辨疑a] 元素化合价的递变规律 作者:段文娟 来源:未知 日期:2012-05-12 20:25:07 点击:12535 所属专题:化合价
元素的化合价随着原子序数递增而呈周期性的变化。同一周期主族元素最高化合价从左至右是递增的;同族元素的化合价基本一样;对大多数元素来说,它们的最高化合价与其所在周期表中的族序数相等。例如,第三周期的钠、镁、铝、硅、磷、硫、氯各元素分别处于ⅠA,ⅡA,ⅢA,ⅣA...
 [注解与辨疑a] 非金属含氧酸规律与性质 作者:鲁群 来源:未知 日期:2017-09-09 09:06:36 点击:9226 所属专题:常见酸
[注解与辨疑a] 非金属含氧酸规律与性质 作者:鲁群 来源:未知 日期:2017-09-09 09:06:36 点击:9226 所属专题:常见酸
非金属元素中,多数都能形成氧化物。除少数氧化物呈中性外,多数非金属氧化物都是酸性氧化物,所以能与碱或碱性氧化物反应。这些酸性氧化物对应的水化物,就是非金属含氧酸,如H 2 SO 4 、HNO 3 、H 3 PO 4 等。 1.含氧酸的酸性 含氧酸中,有的酸性强,如H 2 SO 4 、HN...
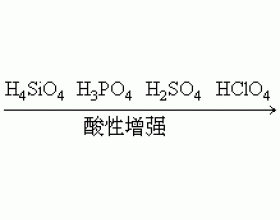
 [注解与辨疑a] 气态氢化物水溶液酸性强弱与元素非金属性强弱的关系 作者:祝其君 来源:未知 日期:2016-01-24 18:27:33 点击:19446 所属专题:氢化物 非金属性
[注解与辨疑a] 气态氢化物水溶液酸性强弱与元素非金属性强弱的关系 作者:祝其君 来源:未知 日期:2016-01-24 18:27:33 点击:19446 所属专题:氢化物 非金属性
元素的最高价氧化物的水化物酸性强弱往往反映元素的非金属性的强弱。例如,P、S、Cl为同周期元素,它们的非金属性由弱至强的顺序是P<S<Cl,它们的最高价氧化物的水化物酸性由弱至强的顺序是H 3 PO 4 <H 2 SO 4 <HClO 4 。N、P、As为同主族元素,非金属性由强至弱的...
 [注解与辨疑a] 非金属氢化物规律介绍 作者:郝军 来源:未知 日期:2016-01-24 18:26:16 点击:13885 所属专题:氢化物
[注解与辨疑a] 非金属氢化物规律介绍 作者:郝军 来源:未知 日期:2016-01-24 18:26:16 点击:13885 所属专题:氢化物
在非金属元素中,除零族元素外,多数都能与氢以共价键结合,形成氢化物。其中,C、Si、B等还能形成一系列氢化物。这里要讨论的是非金属最简单的氢化物,如下表所列: IVA VA VIA VIIA CH 4 NH 3 H 2 O HF SiH 4 PH 3 H 2 S HCl A sH 3 H 2 Se HBr H 2 Te HI 以上氢化物...
 [注解与辨疑a] 元素的化合价与原子结构的关系 作者:王宗峰 来源:未知 日期:2012-12-03 10:12:39 点击:12875 所属专题:化合价
[注解与辨疑a] 元素的化合价与原子结构的关系 作者:王宗峰 来源:未知 日期:2012-12-03 10:12:39 点击:12875 所属专题:化合价
元素的化合价是一种元素一定数目的原子跟其他元素一定数目的原子化合的性质。元素的化合价和元素的原子结构,特别是最外层电子有密切的关系。 在离子化合物里,元素的化合价的数值就是这种元素的一个原子得失电子的数目。在共价化合物里,元素的化合价的数值就是这种元...
 [注解与辨疑a] 浅谈最外层电子的作用 作者:邵磊 来源:未知 日期:2016-01-24 19:30:19 点击:15639 所属专题:最外层电子 价电子
[注解与辨疑a] 浅谈最外层电子的作用 作者:邵磊 来源:未知 日期:2016-01-24 19:30:19 点击:15639 所属专题:最外层电子 价电子
一、最外层电子可以确定物质的化学键类型 一般说来,最外层电子数大于4的原子与最外层电子数小于4的原子彼此间容易得失电子形成阴阳离子,离子间以静电吸引力作用而形成离子键(如NaCl);最外层电子数大于或等于4的原子间容易共用电子对而形成共价键(如N≡N,C-C);...
 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。【导读】键长和键能的关系在化学中通常表现为反比规律:键长越短,键能越大,但受原子...
...
元素周期律的应用,总会遇到金属性和非金属性强弱判断和比较。 苏教版《化学必修第一...
一、研究历史 自然界中物质常见的存在形式有气态、液态和固态,决定物质状态的主要原...
人教版高中化学必修第一册2019年6月第1版2024年7月第8次印刷P 10 3 讲解卤素单质与氢...
冰在0℃开始融化。这是本家都熟悉的事儿。 然而,世界上竟有热冰它在3.8℃方才融化! ...
1. 为什么 HF 分子间氢键比 H 2 O 分子间氢键强,而 HF 的沸点却比 H 2 O 的低? 由于...
1、为什么氧、氟没有最高正价?(朱朝宇) 氟是非金属性最强的元素,理论上没有哪种物...