
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
在任何一个分子中都可以找到一个正电荷重心和一个负电荷重心,根据正负电荷重心是否重合,可以把分子分为极性分子和非极性分子。如果分子中正电荷的重心与负电荷的重心相重合,那就是非极性分子;如果正负电荷重心不重合,则分子就因显正负两极而形成偶极,这种分子叫做极性分子。分子中正负电荷重心相距愈远,分子的极性也就愈显著,这个距离叫做偶极长度。如果正负电荷重心分离得很远,这个分子就属于离子型分子了。图①简略地表示了各种类型分子的电荷分布情况,图中“+”和“-”表示正负电荷重心的相对位置,也就是分子的极性。
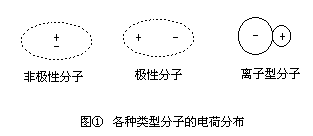
对于双原子分子来说,分子的极性是由键的极性引起的。由两个相同的原子所形成的化合物,由于它们的电负性相同,分子中电荷的分布是对称的,整个分子的正电荷重心与负电荷重心重合,这种分子叫做非极性分子,这种键叫做非极性共价键。
由两种不同元素的原子所形成的化合物,由于元素的电负性不同,分子中电荷的分布不对称,即正负电荷重心不会重合,在分子中形成了正负两极。这种分子叫极性分子,这种键叫极性共价键。
分子极性的强弱是用偶极矩(μ)来度量的,偶极矩即等于偶极长(d)和偶极上一端电荷(q)的乘积。即:
μ=qd
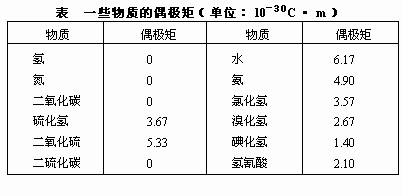
偶极矩是一个向量,它的方向规定为从正到负。偶极矩可用实验方法测定。因为分子中原子间距离的数量级为10-10m,电荷的数量级为1.6×10-19C,所以偶极矩的数量级为10-30C·m。下表列出某些物质的偶极矩。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。
 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。
金属性与金属活动性是两个不同概念。中学教材中金属性强弱的...
并非。它们可以形成多种多样的化合物,尤其是在特定条件下。...
“它很稳定,化学性质不活泼”——是中学化学领域经常的“口...
本文将给出基于八隅律的电子式的书写步骤。与以往教学不同之...
氯离子(Cl)的半径大于铯离子(Cs)!!!课本上没有错哦!...
含氧酸是酸中的主角,常见的含氧酸中,有高某酸、正某酸、亚...