
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
1.如何理解“水解”反应的概念?
“水解”,顾名思义,可理解为“某物质遇水分解”,也可理解为“该物质使水分解”。
其实上述二者的含义同在。从微观层面看,可理解为发生水解的物质与水分子同时解离开来,分别变为正电性、负电性的部分,然后按照“己方的正电性部分跟对方的负电性部分重新结合”的规则,构成新物质。
以物质A—B水解为例图示如下:

A将上述作用模式具体化,则有如下各水解反应:
盐的水解:
NaAc + H2O →NaOH +HAc(微弱,因逆向为自发的酸碱中和反应)
电石水解制乙炔:
CaC2+2H2O → Ca(OH)2+H-C≡C-H(C2H2)
卤代烃水解:
C2H5—Br + H2O → C2H5—OH + HBr
酯类水解:

其它物质的水解:
PCl5+4H2O → H3PO4[可理解为P(OH)5脱一分子水后的产物] + 5HCl
ICl + H2O → I-OH + HCl
2.盐类为什么会发生水解?
首先要明确,并非所有的盐都发生水解。只有那些由弱酸或弱碱中和而来的盐,才会发生水解反应。
化学平衡状态无论从正向(从反应物出发)、还是从逆向(从产物出发)都可以达成。盐类水解的根本原因在于,盐电离出的弱酸根阴离子或弱碱阳离子,会结合H2O电离出的H+或OH-,从逆向达到弱酸、弱碱的电离平衡。
把醋酸钠溶于水,电离出CH3COO-,而H2O也会电离产生H+,于是,CH3COO-就会结合这些H+,从逆向达到弱电解质醋酸的电离平衡。因H+由最弱的电解质H2O电离而来,故不可写作离子形式,要保留弱电解质H2O的分子式。于是有:
CH3COO-+ H2O≒CH3COOH + OH-
3.弱电解质电离是吸热的,水解既然是其逆过程,为什么也是吸热的?
让我们以CH3COOH电离和CH3COO-水解为例分析如下:
前提是醋酸电离过程吸热,热化学方程式如下:
CH3COOH(aq)≒CH3COO-(aq) + H+(aq) ΔH1>0 ………①
CH3COO-(aq)+ H2O(l)≒CH3COOH(aq) + OH-(aq) ΔH2 …②
我们看到,①、②这两个过程,并非简单的互为可逆。①、②叠加的结果是:
H2O(l)≒H+(aq) + OH-(aq) ΔH3>0
ΔH1+ΔH2=ΔH3
电离理论下,水是人们默认的最弱电解质。这就意味着,水电离过程吸热量要高于常见的其它弱电解质。
即ΔH3>ΔH1,根据上式可推知,ΔH2=ΔH3-ΔH1>0。
所以,绝大多数弱电解质离子水解过程都是吸热的。
值得注意的是,并非任何水解过程均吸热。
首先,像“Al3++ HCO3-”等一些相互促进水解的反应,一般都是放热的。其次像一些极弱酸的盐,如CaC2(乙炔可看作极弱的酸,CaC2看作乙炔的盐)的水解过程,也是放热的。
4.醋酸电离出的醋酸根离子是否会发生水解?
这是一个有趣的问题。要给出确切的回答,还得从水解的本质出发分析。
我们以0.1 mol/L 的CH3COOH溶液为例:根据醋酸的电离常数Ka=1.8×10-5可计算出,该溶液中,H+浓度为1.3×10-3mol/L,主要由CH3COOH电离产生,H2O电离出的H+极小,
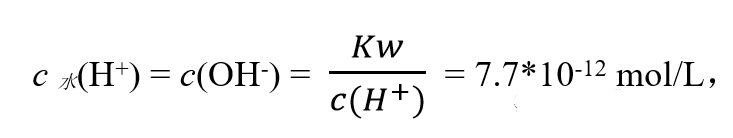
这跟醋酸本身电离出的1.3×10-3mol/L 相比可忽略不计。
CH3COO-水解的本质是什么?是它结合溶液中水电离出的H+,从逆向达到醋酸电离平衡的过程。
现在溶液里由醋酸电离的H+为1.3×10-3mol/L,而由H2O电离出的H+浓度仅7.7×10-12mol/L。约为CH3COOH自身电离出H+浓度的2亿分之一!
那么,CH3COO-结合H+时,是否一定要专门去找那水电离出的两亿分之一的H+呢?显然不需要。
所以我们说,在醋酸溶液里,是不需要考虑CH3COO-水解的。
同样道理,在CH3COONa溶液里,也不需要考虑CH3COO-水解产生的醋酸分子的电离。
5.如何判断弱酸酸式盐(NaHCO3)溶液的酸碱性?
多元酸的酸式盐中,像NaHSO4这种二元强酸的酸式盐,由于HsO4-只会电离、不水解,所以NaHSO4溶液必然呈酸性。
而NaHCO3就不同了,因HCO3-离子既发生电离(呈酸性),又会发生水解(呈碱性),故具有两性。那么NaHCO3的水溶液为什么呈弱碱性呢?
推导过程如下:
已知H2CO3的Ka1= 4.3×10-7;Ka2= 5.6×10-11。
电离平衡:HCO3-+ H2O≒H3O++ CO32-,
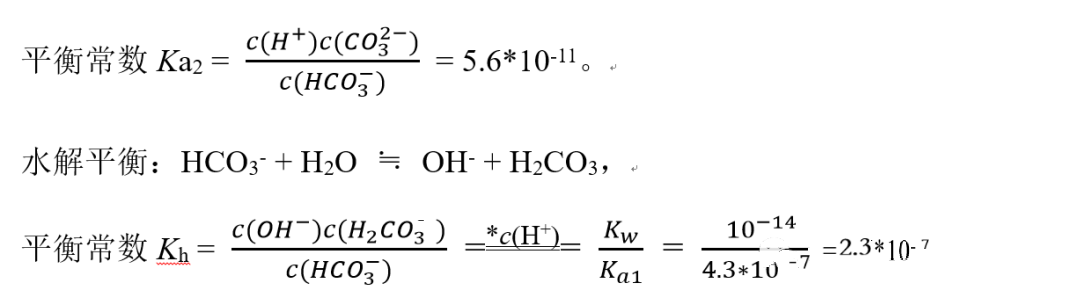
我们看到,HCO3-的电离表达式、水解表达式基本一致,都是一个HCO3-(跟H2O作用,只是H2O的浓度项均没有计入平衡常数表达式)变为2个分子或离子,故平衡常数大小即决定了其电离、水解程度的强弱。
现Kh >Ka2,所以我们说HCO3-以水解为主,其水溶液显弱碱性。
按照同样的计算方式,依据磷酸的三级电离常数(Ka1= 7.5×10-3;Ka2= 6.2×10-8;Ka3= 2.2×10-13)可以推导出如下结论:NaH2PO4溶液呈弱酸性(电离程度大于水解程度)、Na2HPO4溶液呈弱碱性(水解程度大于电离程度)。大家不妨一试。
6.为什么有的弱酸弱碱盐彻底水解而有的不会?什么样的盐会彻底水解?
应该说,弱酸弱碱盐中,除了CH3COONH4这种极为特别的盐外,几乎都会因为阴、阳离子分别水解显碱性、酸性,相互促进而彻底水解。这样的水解反应用“=”而非“≒”表示。比如:
2Al3++ 3S2-+6H2O = 2Al(OH)3↓+ 3CO2↑,
Fe3++ 3HCO3-= Fe(OH)3↓ + 3CO2↑,
Fe3++ 3ClO-+ 3H2O = Fe(OH)3↓ + 3HClO,
NH4++ CO32-+ H2O = HCO3-+ NH3·H2O……
那么,为什么CH3COONH4在溶液里却不会因CH3COO-、NH4+相互促进水解而完全反应掉呢?这需要结合反应产物的性质,依据平衡移动原理加以理解。
CH3COO-+ NH4++ H2O≒CH3COOH + NH3·H2O
首先我们知道,CH3COO-、NH4+均为一价离子,水解程度相对较弱;其次我们看到,水解产物CH3COOH、NH3·H2O在水溶液里均可形成非常高浓度的溶液(CH3COOH可以任意比例溶解于水,NH3在水中有极大的溶解度),这样就可以抑制其水解平衡。
7.AlCl3溶液蒸干时会因水解得不到无水AlCl3。那么,硫酸铝溶液蒸干能够得到无水硫酸铝吗?
二者在稀溶液里水解反应的化学方程式分别是:
AlCl3+3H2O≒Al(OH)3+3HCl;
Al2(SO4)3+6H2O≒2Al(OH)3+3H2SO4
AlCl3溶液蒸干不能得到纯净的AlCl3,是因为水解产物HCl太容易挥发,导致产物中出现大量Al(OH)3[或碱式氯化铝Al(OH)2Cl、Al(OH)Cl2等],如果进一步将所得固体灼烧,则HCl挥发殆尽,Al(OH)3也彻底分解,最终得到Al2O3。
而硫酸铝溶液蒸发,则最终能够得到硫酸铝本身。这是因为水比硫酸更容易挥发,随着水的不断蒸发,硫酸浓度变大,可完全抑制水解。
当然,你也可以认为原来稀溶液里水解产生的Al(OH)3被浓硫酸中和“回去”了。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。1. 如何理解 “ 水解 ” 反应的概念? “ 水解 ” ,顾名思义,可理解为 “ 某物质遇...
为什么NaHCO 3 溶液能与Na[Al(OH) 4 ]溶液反应? NaHSO 3 溶液之所以能与Na[Al(OH) 4 ...
双水解程度计算: 同样是双水解,为什么CH 3 COO - 和 NH 4 + 可以大量共存,而Al 3...
我们在看到酸碱中和滴定图像时,看到反应一半点处图像很平缓,这是因为这一部分成分构...
请教:恒温下向CH 3 COONa稀溶液中加入少量固体醋酸钠 c (CH 3 COO - )/ c (Na + )...
热冰,一个看似矛盾却又真实存在的物质,打破了我们对冰与热的传统认知。它是一种在高...