
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
1.从乙醇跟金属钠反应生成H2这一事实看,乙醇可以电离产生H+。可是为什么还说乙醇属于非电解质?
乙醇是由乙烷(CH3-CH3)与水(H-OH)相互作用而成的化合物:
![]()
因此,乙醇应该“继承”了乙烷、水的某些性质。如乙醇可燃烧、能溶于苯也能溶解苯等有机物,这些性质可看作来自乙烷;而乙醇易溶于水、跟钠反应等性质则可看作是水带来的。
羟基(-OH)氢原子均可在一定条件下发生电离产生H+,如H2O、羧酸及一切无机含氧酸(H2SO4、HNO3、H2CO3等),只是不同物质里的-OH电离程度不同而已。在一定的外界条件下,-OH上的氢原子是否易电离取决于其中氧-氢键的极性强弱,极性强则易电离,极性弱则难电离。
在乙醇分子里,由于乙基是饱和烃基,它们属于“推电子基团”,其推电子的直接后果就是导致醇羟基上氧原子周围电子云密度加大,对氧氢键上电子云的吸引力减弱,使氧-氢键极性变弱,故不易电离。所以,乙醇中的H+浓度不如H2O里的大,这一点我们从乙醇跟钠反应的剧烈程度不如水可以看出。
关于电解质的概念,科学上有一个约定俗成的标准——凡是电离能力比水强的物质才能称为电解质,而电离程度不如水的,则被归入“非电解质”的范畴。由于乙醇的电离程度一般不如水,故它属于非电解质。同样道理,NH3在液体状态下也能发生微弱电离:NH3= NH2-+ H+,这一点通过金属钠跟液氨反应放出H2可以得到证实,但我们说NH3属于非电解质(注意!NH3·H2O则属于电解质),原因就是它电离的程度不如水。
2.用乙醇与浓硫酸的混合物制取乙烯,需要加热到170℃,乙醇的沸点只有78.5℃,在170℃之前乙醇岂不全部挥发光了?
乙醇脱水不是像化学方程式表达得那样简单,而是经历了非常复杂的过程。乙醇在跟浓硫酸混合的过程中,其实已经跟硫酸发生了如下反应:
C2H5-OH+ HO-SO3H→C2H5-O-SO3H(硫酸氢乙酯)+ H2O
生成的硫酸氢乙酯沸点约280℃,显然升温到170℃它是不会挥发掉的。这个硫酸氢乙酯在不同温度下会发生不同的反应,如140℃时,它会跟另一分子乙醇作用脱去硫酸分子形成乙醚(制乙烯时的主要副反应):
C2H5-O-SO3H+ HO-C2H5→C2H5-O-C2H5+H2SO4
而170℃左右,它会自身脱去一分子硫酸形成乙烯:
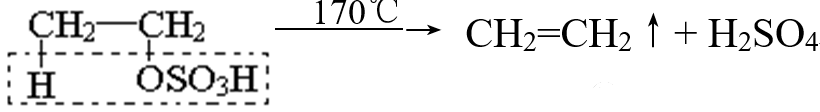
而若把硫酸氢乙酯溶解于水,则它会发生水解,变回乙醇与硫酸(稀硫酸)。值得顺便一提的是,这正是历史上用硫酸催化乙烯制乙醇的反应过程:乙烯通入浓硫酸中被吸收,二者发生加成反应生成硫酸氢乙酯,再使其水解得到乙醇。此法由于稀硫酸浓缩的成本太高,目前已被其它工艺取代。
3.醇与酚均为“烃基+羟基”结构,为什么要分为两类?二者有何异同?
醇与酚的不同缘于链烃基和苯环对羟基的影响结果不同。前边分析乙醇的性质时已指出,链烃基属于推电子集团,故醇羟基电离程度比水弱,醇属于非电解质。
而酚的分子中,酚羟基上氧原子跟苯环平面上碳原子间存在p-π共轭效应,共轭效应导致体系内电子云的平均化,因氧原子的2p轨道上是一对电子,而与之共轭的碳原子的2p轨道却只有一个单电子,故共轭的结果是氧原子周围的电子云向苯环偏移,从而导致酚羟基的氧-氢键极性增强。
故酚比水易电离,具有弱酸性,属于弱电解质。
醇与酚不仅是电离程度的不同。醇分子里的碳-氧键只是一般的单键,比较容易断裂;而酚分子里碳-氧共轭效应增加了电子云的重叠,使得碳-氧键被大大增强,不易断裂。酚不易发生分子间脱水成醚、不易直接跟羧酸发生酯化反应就与此有关。
值得注意的是,醇跟酚毕竟都是烃的羟基衍生物,它们有很多方面性质相似,如都能跟活泼金属反应放出H2,都能在一定条件下形成醚、酯等。
4.为什么CO2通入苯酚钠溶液时只能生成NaHCO3、不能生成Na2CO3?
这与苯酚C6H5-OH、碳酸H2CO3、碳酸氢根离子HCO3-的酸性相对强弱有关。
查阅数据手册可得:Ka(C6H5OH)=1.3×10-10,Ka1(H2CO3)=4.5×10-7,Ka2(H2CO3)=4.7×10-11,可见酸性强弱关系:
H2CO3>C6H5OH>HCO3-。
根据强酸制弱酸规律,强酸可以把弱酸从其盐溶液里置换出来,即有:
H2CO3+C6H5O-= C6H5OH + HCO3-
C6H5OH+ CO32-= C6H5O-+ HCO3-
也就是说,苯酚跟碳酸根离子易发生反应,故苯酚钠溶液里通CO2时只能生成HCO3-,不易生成CO32-。
5.为什么做苯酚与溴反应的实验时要用过量的浓溴水?
苯与溴单质很容易发生取代反应,得2,4,6-三溴苯酚,该化合物呈白色、难溶于水。故可用溴水检验苯酚的存在。
但是我们要注意,2,4,6-三溴苯酚虽然不溶于水,却能溶解于苯酚的稀溶液中。所以,如果苯酚与溴反应时苯酚过量,则往往看不到白色沉淀。
要想观察到白色沉淀这一现象,就必须使用过量的溴。因溴在水里溶解度不大,故该实验强调使用“过量浓溴水”。
顺便提及,要除去苯里溶解的少量苯酚,也不要想当然地使用浓溴水。这是因为,2,4,6-三溴苯酚可溶于苯,使用浓溴水只是把苯中的苯酚杂质转化为另一杂质2,4,6-三溴苯酚而已。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。一、吡咯的结构 氮原子的杂化:氮原子采用sp杂化,形成2个σ键(与相邻碳原子)和1个...
共轭效应一定是给电子的,诱导作用一定是吸电子的!但其实这明显是个驳论。因为共轭作...
氨及其衍生物 表现出碱性的氨及其衍生物主要包括脂肪胺、氨、芳香胺、酰胺、酰亚胺、...
在中学化学中,杂环化合物确实比较陌生,但可以用它作为情境考查其他知识。 在化学试...
1 .从乙醇跟金属钠反应生成 H 2 这一事实看,乙醇可以电离产生 H + 。可是为什么还说...
在有机化学中,胺(-NH以及其衍生物如-NHR、-NR,其中R代表烷基或其他取代基)的碱性...