
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
一、公式推导
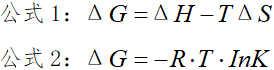
公式1是大家都熟悉的吉普斯自由能公式,用来判断反应能否自发进行以及自发进行的温度。
公式2(常常出现在题目的已知信息中)相同温度下,K越大,ΔG越小,反应的趋势越大,反应越完全。
ΔG:吉普斯自由能
R: 摩尔气体常量,8.314J/(mol·K)
K: 化学平衡常数
将两个公式联立,可以得出一个新的公式:
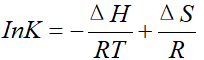
这就是范特霍夫方程。
二、公式应用
范特霍夫方程有三个应用。
第一,解释温度对平衡移动反向的影响。
假设温度为T1时,化学平衡常数的值为K1
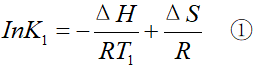
温度升高到T2后,化学平衡常数的值为K2
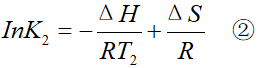
①式比②式,得:
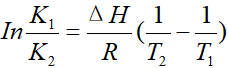
T2>T1,所以1/T2-1/T1<0。
当ΔH<0时,K1/K2>1,K1>K2,平衡逆行移动,也就是朝吸热的方向移动。
当ΔH>0时,K1/K2<1,K1<K2,平衡正向移动,也就是朝吸热的方向移动。
这就是我们课本上的结论:当其他条件不变时,温度升高,平衡朝着吸热的方向移动。
第二,解释改变相同温度,焓变绝对值大小和平衡移动程度的关系。
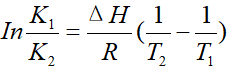
这是上面👆已经得出的公式。改变相同温度,即1/T2-1/T1为定值,假设这一项的值小于0(大于0方法相同,自行推导)
当ΔH<0时,ΔH的绝对值越大,K1/K2越大,平衡逆向移动的程度越大。
当ΔH>0时,ΔH的值越大,K1/K2越小,平衡正向移动的程度越大。
综上所诉,改变相同温度时,焓变的绝对值越大,平衡的移动程度越大。
回到刚刚的真题,反应2焓变的绝对值最大,升高相同温度,逆向移动的程度最大,所以答案选B。
第三,理解图像的含义。
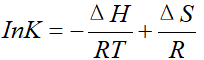
根据范特霍夫方程可知,InK和1/T在坐标系中为线性关系,斜率表示 -ΔH/R,在y轴上的截距表示ΔS/R
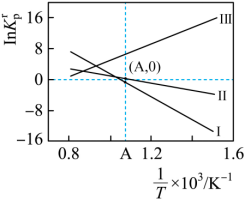
从InK-1/T的图像中,可以判断反应的焓变和熵变。
反应Ⅰ,ΔH1>0,ΔS1>0;
反应Ⅱ,ΔH2>0,ΔS2>0;
反应Ⅲ,ΔH3<0,ΔS3<0。
进一步可以分别比较焓变、熵变的大小,判断反应能否自发进行和自发进行的温度。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。
 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。
...
一、公式提出的背景 19世纪末,化学家们逐渐意识到温度对化学...
假设对于反应 a A(g) + b B(g) g G(g) + h H(g) 中各物质均为理想气体,...
例:某温度、起始压强为100 kPa下,若将2mol SO 2 和1molO 2 ,通入恒...
...
什么是活化能、能垒? 1 、能垒 活化分子含有的能参加化学反应...