
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
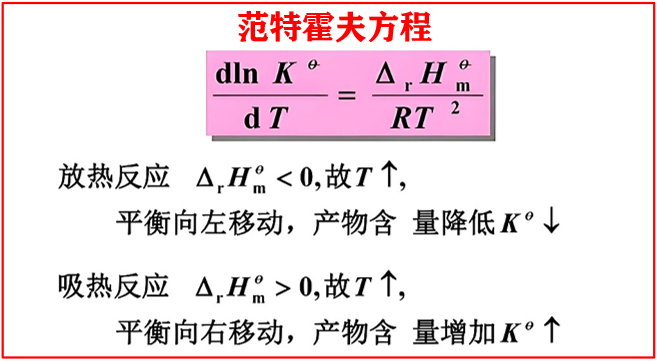
【导读】范特霍夫方程很好的描述了可逆反应的化学平衡常数(K)与温度(T)的关系,其核心规律:平衡常数随温度的变化取决于反应的热效应(ΔH)。
①吸热反应(ΔH>0):
②放热反应(ΔH<0):
一:范特霍夫方程是什么?
范特霍夫方程建立了K与T的定量关系:
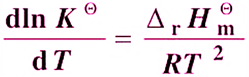
积分形式(假设ΔH不随温度变化):
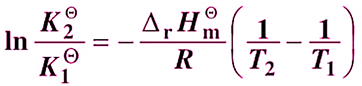
K1,K2:温度T1,T2时的平衡常数
ΔH:标准反应焓变(吸热为正,放热为负)
R:气体常数(8.314 J/mol·K)
由范特霍夫方程可明确得出结论:
1.ΔH>0(吸热)→lnK随1/T减小而增大→升温使K增大
2.ΔH<0(放热)→lnK随1/T减小而减小→升温使K减小

二:吸热反应K值变化的典例(升温使K增大)
反应:合成氨的逆反应(氨的分解)2NH3(g)⇌N2(g)+3H2(g) ΔH=+92.4kJ/mol
温度对K的影响:

温度从25°C→500°C,Kp值从1.5×10-6提升6.7×104,所以温度越高其分解越彻底。由此:在吸热反应中,升温使平衡向正反应方向(分解)移动,Kp值增大。

三:放热反应K值变化的典例(升温使K减小)
反应:合成氨(工业哈伯法)N2(g)+3H2(g)⇌2NH3(g)ΔH=−92.4kJ/mol
温度对Kp的影响:
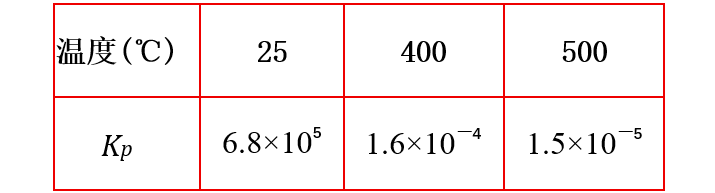
温度从25°C→500°C,Kp从6.8×105暴跌至1.5×10−5,所以温度上升氨的产率急剧下降。由此:工业合成氨中低温利于平衡右移(Kp大),但温度降低会带来反应速率极慢;高温加快反应速率,但Kp极小,所以需折中选择400-500°C,并使用铁媒催化剂。

四:特殊反应ΔH数值较小时K值变化不大
反应:水煤气变换反应 CO(g)+H2O(g)⇌CO2(g)+H2(g)ΔH=−41.2kJ/mol(弱放热)
温度对K的影响(近似计算):
T1=298K时,K1≈1.0×105
T2=700K时:
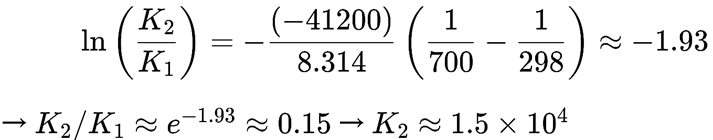
升温使K减小,但变化幅度不大(因ΔH较小)。
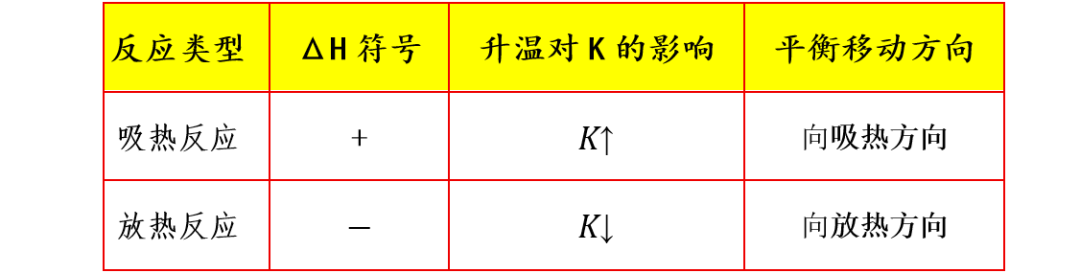
五:用勒夏特列原理的视角解释升温对K值的影响
升高温度时,平衡向吸热方向移动,以减弱温度升高的影响,所以温度升高时,吸热反应的K增大,放热反应的K减小。

六:为什么温度不影响平衡常数单位?
平衡常数K的单位由反应计量数决定(如Kp单位为(atm)Δn),但数值大小由ΔG=−RTlnK关联。
温度T变化时,ΔG中的焓变(ΔH)和熵变(ΔS)共同作用,通过范特霍夫方程体现为K的变化。

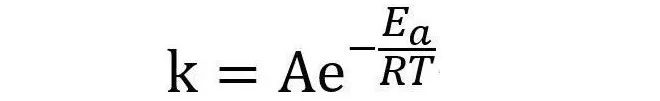
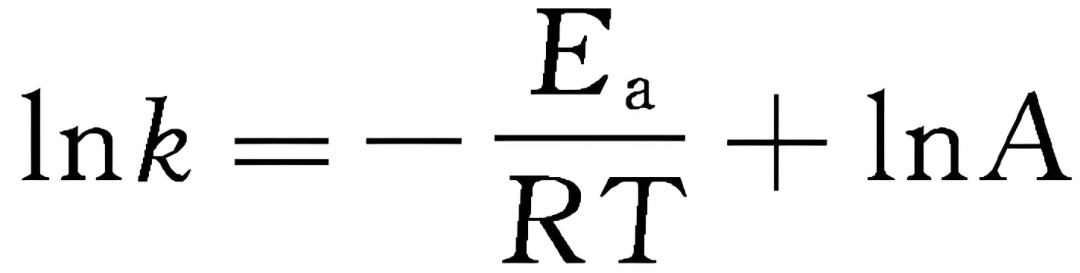

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。
 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。
在化学反应中,驱动力指的是推动反应进行的内在因素,它决定...
一.核心概念辨析 中间体:寿命长于分子振动的瞬态物种,多步...
活化分子百分数和活化分子数,理解它对掌握化学反应速率至关...
化学反应的焓变越大,代表这个反应受温度变化的影响越大吗?...
在化学热力学和分析化学中,我们常常听到这样的说法:“如果...
...