
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
在一个恒温恒容的密闭容器里,充入2mol SO2和1mol O2,发生如下反应并建立化学平衡:2SO2(g) + O2(g)⇌2SO3(g),若向该容器中再充入一定量SO3气体,当达到新平衡时,下列相关说法错误的是( )
(A)正、逆反应速率均比原平衡大
(B)SO2的体积分数比原平衡大
(C)混合气体的密度比原平衡大
(D)混合气体的平均相对分子质量比原平衡大
答案:B
【分析】依据勒夏特列原理,充入SO3气体,会使上述平衡逆向移动,使反应体系中SO2增多。这时,容易产生的直觉是——SO2的体积分数应比原平衡大。遗憾的是,最终的答案却告诉我们,新平衡时SO2的体积分数比原平衡小。
为什么直觉错了?
主要有两个原因:
一是对混合气体中某气体的体积分数如何确定没有正确理解;
二是将“平衡逆向移动会使SO2物质的量浓度增大”的推论错误延伸为“SO2的体积分数增大”。
我们先来了解,混合气体中某组分(A)的体积分数(φA)是如何确定的。见下面计算关系式:

还有一个规律——同温同压下气体体积之比等于其物质的量之比(可借助理想气体状态方程PV=nRT理解),也等于其物质的量浓度之比。其关系式可表示为:
接着,我们继续分析上述例题中充入SO3气体后,建立新平衡时的SO2的体积分数究竟如何变化。
设原平衡中各物质的浓度为:
C(SO2) = Xmol·L-1;
故该反应在该温度下的平衡常数为:
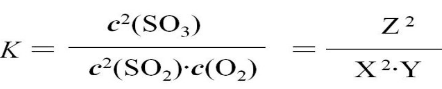
原平衡中SO2的体积分数为:
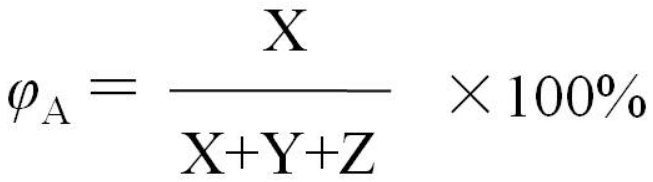
充入一定量SO3气体后,平衡逆向移动,建立新平衡时,使SO2、O2的浓度增大到原来m倍,此时SO3的浓度为原来n倍。由于温度不变,所以平衡常数也不变。
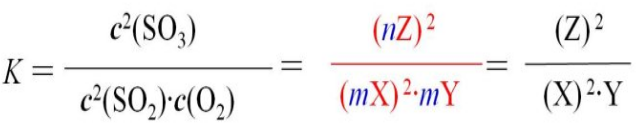
显然,式中
新平衡时SO2的体积分数为:
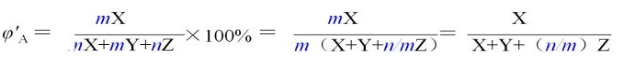
由于n/m>1,所以,新平衡时SO2的体积分数比原平衡小,即:
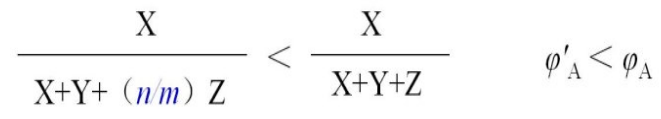
可以认为,在恒温恒容条件下,对于气体体积缩小的可逆反应,上述结论是有实用性的。例如,用上述方法分析合成氨反应,也会得出同样的结论。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。一、基本定义 (一)中间体 1、根据国际纯粹与应用化学联合会(IUPAC)的权威定义,中...
前言:阿伦尼乌斯公式是物理化学中定量描述温度对反应速率影响的基石。尽管其对数形式...
一、 催化剂中毒 催化剂中毒是指微量或少量的外来物质(毒物)与催化剂的活性中心发生...
在化学热力学与工业生产的交叉领域,范特霍夫方程将平衡常数与温度的抽象关系转化为可...
在化学平衡的学习中,压强对气体平衡的影响与水溶液中“越稀越电离、越稀越水解”的规...
在化学动力学研究中,基元反应是理解反应机理的 “最小单元”,而反应速率方程则是描...