
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
一、化学平衡移动的标志
①正逆反应速率的标志:V(正)≠V(逆)是平衡移动的根本原因。V(正)>V(逆),平衡向正反应方向移动;V(正)=V(逆),平衡不移动。处在平衡状态;V(正)<V(逆),平衡向逆反应方向移动。
②化学量的标志:生成物的物质的量增多,标志平衡朝正反应方向移动;生成物物质的量减少,标志平衡朝逆反应方向移动。
③对于改变温度,生成物物质的量增多,会导致反应物物质的量减少,反应物浓度减少,反
应物转化率增大,反应物百分含量减少,生成物浓度增加,生成物百分含量增加,意味着
平衡正向移动;生成物物质的量减少,会导致反应物物质的量增加,反应物浓度的增加,
反应物转化率降低,反应物百分含量增加,生成物浓度的减少,生成物百分含量减少,意味平衡逆向移动。
④对于改变体积来改变压强的情况,生成物物质的量增多,会导致反应物物质的量减少,反反应物转化率增大,反应物百分含量减少,生成物百分含量增加,意味着平衡正向移动;生成物物质的量减少,会导致反应物物质的量增加,反应物转化率降低,反应物百分含量增加,生成物百分含量减少,意味平衡逆向移动。但反应物的浓度与生成物的浓度由于存在体积的分母效应,不能作为平衡移动的标志。
⑤对于改变浓度来说,增加一种反应物的浓度,会导致另一种反应物的转化率增大,浓度减少,百分含量减少,生成物物质的量增加,生成物浓度增加,平衡正向移动。但本身的转化率下降,浓度增加,百分含量增加。
二、三种浓度改变平衡移动和化学量改变情况的分析
①对于一个气体分子数减少的反应,如2SO2+O2![]() 2SO3,在同温同体积的密闭容器中进行反应,如果同时等倍增加SO2和O2的量,平衡向正反应方向移动,SO2和O2的转化率会提高,SO2和O2的体积分数会减少,SO3的体积分数会增加。
2SO3,在同温同体积的密闭容器中进行反应,如果同时等倍增加SO2和O2的量,平衡向正反应方向移动,SO2和O2的转化率会提高,SO2和O2的体积分数会减少,SO3的体积分数会增加。
②对于一个气体分子数不变的反应,如:H2(g)+I2 (g)![]() 2HI(g),在同温同体积的密闭容器中进行反应,如果等倍增加H2和I2的量,平衡会向正反应方向移动,但H2和I2的转化率不变,SO2和O2的体积分数不变,SO3的体积分数也不变。
2HI(g),在同温同体积的密闭容器中进行反应,如果等倍增加H2和I2的量,平衡会向正反应方向移动,但H2和I2的转化率不变,SO2和O2的体积分数不变,SO3的体积分数也不变。
③对于一个气体分子数增大的反应,如:N2O4![]() 2NO2,在同温同体积的密闭容器中进行反应,如果等倍增加N2O4的量,平衡会向正反应方向移动,但N2O4的转化率降低,N2O4体积分数增大,SO3的体积分数也减少。
2NO2,在同温同体积的密闭容器中进行反应,如果等倍增加N2O4的量,平衡会向正反应方向移动,但N2O4的转化率降低,N2O4体积分数增大,SO3的体积分数也减少。
三、强化练习
1、已知反应A2(g)+2B2(g)![]() 2AB2(g)的ΔH<0,下列说法正确的是()
2AB2(g)的ΔH<0,下列说法正确的是()
A、升高温度,正向反应速率增加,逆向反应速率减小
B、升高温度有利于反应速率增加,从而缩短达到平衡的时间
C、达到平衡后,升高温度或增大压强都有利于该反应平衡正向移动
D、达到平衡后,降低温度或减小压强都有利于该反应平衡正向移动
2、在密闭容器中,一定条件下,进行如下反应:NO(g)+CO(g)=2N2(g)+CO2(g);ΔH=-373.2KJ/mol,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是( )
A、加催化剂同时升高温度 B 加催化剂同时增大压强
C、升高温度同时充入N2 D降低温度同时增大压强
3、在体积可变的密闭容器中,反应mA(g)+nB(s)![]() pC(g)达到平衡后,压缩容器的体积,发现a 的转化率随之降低。下列说法中,正确的是()
pC(g)达到平衡后,压缩容器的体积,发现a 的转化率随之降低。下列说法中,正确的是()
A、m+n 必定小于p B、m+n 必定大于p C、m 必定小于p D、n必定大于p
4、右图是温度和压强对X+Y![]() 2z 反应影响的示意图。图中横坐标表示温度,纵坐标表示平衡混合气体中z 的体积分数。下列叙述正确的是( )
2z 反应影响的示意图。图中横坐标表示温度,纵坐标表示平衡混合气体中z 的体积分数。下列叙述正确的是( )
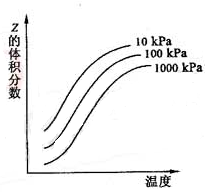
A、上述可逆反应的正反应为放热反应
B、X、Y、Z均为气态
C、X和y 中只有一种为气态,Z为气态
D、上述反应的逆反应的ΔH>0
5、已知可逆反应:2NO2(g)![]() N2O4(g)ΔH=QKJ/mol。现将一密闭容器的NO2和N2O4的混合气体置于100℃的水中,发现容器中的盐酸变深了,则下列说法正确的是()
N2O4(g)ΔH=QKJ/mol。现将一密闭容器的NO2和N2O4的混合气体置于100℃的水中,发现容器中的盐酸变深了,则下列说法正确的是()
A、Q<0 B、Q>0 C、升高温度,平衡正向移动 D、降低温度,平衡逆向移动
6、下列事实不能用勒夏特列原理解释的是()
A、碳酸钠溶于促进水的电离 B、打开汽水瓶有大量气泡冒出
C、灭火器常用硫酸铝和碳酸氢钠 D、实验室用H2O2制备O2常用MnO2作催化剂
7、反应2X(g)+Y(g)![]() 2Z(g)ΔH<0,在不同温度(T1和T2)及压强(P1和P2)下,产物z 的物质的量(N2)与反应时间(T)的关系如图所示。下列说明正确的是()
2Z(g)ΔH<0,在不同温度(T1和T2)及压强(P1和P2)下,产物z 的物质的量(N2)与反应时间(T)的关系如图所示。下列说明正确的是()
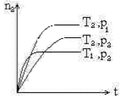
A、T1<T2,P1<P2 B、T1<T2,P1>P2 C、T1>T2,P1>P2 D、T1>T2,P1<P2
8、某温度下,在一密闭容器中充入1mol HI气体,发生如下反应:2HI(g)![]() H2(g)+I2(g)。 反应达到平衡后HI的转化率为X;在相同的温度下,继续向该密闭容器中充入1mol HI气体,反应重新达到平衡后HI的转化率为Y,则x 与Y的关系是( )
H2(g)+I2(g)。 反应达到平衡后HI的转化率为X;在相同的温度下,继续向该密闭容器中充入1mol HI气体,反应重新达到平衡后HI的转化率为Y,则x 与Y的关系是( )
A、X>Y B、X<Y C、X=Y D、无法确定大小关系
9、在恒温时,一固定容积的容器内发生如下反应:2NO2(g)![]() N2O4(g)达到平衡时,再向容器内通入一定量的NO2(g),重新达到平衡后,与第一次平衡时相比,NO2的体积分数()
N2O4(g)达到平衡时,再向容器内通入一定量的NO2(g),重新达到平衡后,与第一次平衡时相比,NO2的体积分数()
A、不变 B、增大 C、减小 D、无法判断
10、二氧化氮存在下列平衡:2NO2(g)![]() N2O4(g)ΔH<0在测定NO2的相对分子量时,下列条件中较为适宜的是()
N2O4(g)ΔH<0在测定NO2的相对分子量时,下列条件中较为适宜的是()
A、温度130℃、压强3.03×105Pa B、温度25℃、压强1.01×105Pa
C、温度130℃、压强5.05×104Pa D、温度0℃、压强5.05×104Pa
11、一真空密闭容器中盛有1mol PCl5,加热到200℃时,发生如下反应PCl5(g)![]() PCl3(g)+Cl2(g)反应达到平衡时,PCl5所占体积百分比为m%。若在同一温度和同一容器中,最初投入的是2mol PCl5,反应平衡时PCl5所占体积百分比为n%。则m和n的正确关系是( )
PCl3(g)+Cl2(g)反应达到平衡时,PCl5所占体积百分比为m%。若在同一温度和同一容器中,最初投入的是2mol PCl5,反应平衡时PCl5所占体积百分比为n%。则m和n的正确关系是( )
A、m>n B、n>m C、m = n D、无法比较

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。什么是能垒、活化能?二者有什么区别? 1、能垒 活化分子含有的能参加化学反应的最低...
1.无论是用某一反应物表示还是用某一生成物表示,由于Δ C 是取浓度变化的绝对值,因...
在一个恒温恒容的密闭容器里,充入2mol SO 2 和1mol O 2 ,发生如下反应并建立化学平...
...
一、人物简介: 阿伦尼乌斯·斯万特·奥古斯特(1859年2月19日~1927年10月2日)瑞典物...
本题考查了阿伦尼乌斯公式中温度和速率常数的关系,即温度升高,速率常数变大。 本题...