
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
一、物质的量
1、为什么引入物质的量,为什么不直接用数目来描述微观粒子,非要增加一个新的物理量?
在化学计算中,用数目计算要比质量计算要简单。
我们有时也直接用数目来描述微观粒子,比如3个e-,1个H2O,2个Na+。
但是在宏观世界的数量中,直接用数目来描述微观粒子不合适。例如,描述30g H2O中水分子的数目,用1亿亿亿个来描述就不太方便。
用物质的量来描述宏观世界中微观粒子的数量很方便。
2、什么是物质的量?
物质的量是以集合体的方式来描述微观粒子数目的物理量。
(1)物质的量表示含一定数目的粒子的集合体。符号为N,单位是mol(摩尔)。
2mol CO2:以集合体的方式在表示CO2的分子数目。
(2)阿伏加德罗常数和6.02×1023:
1mol 的数目是固定的,约为6.02×1023,准确数据为阿伏加德罗常数。
6.02×1023是怎么来的?用12g12C中碳原子的数目来定量的。
为什么要用12g12C来定量?方便建立质量与物质的量之间的联系。
(3)注意:物质的量只描述微观粒子,包括分子、原子、离子、原子团、电子、质子、中子等。
3、物质的量与粒子数之间的关系
(1)用阿伏加德罗常数建立联系
(2)阿伏加德罗常数:1mol 任何粒子的粒子数,符号为NA。通常用6.02×1023mol-1来表示。
(3)1mol表示的粒子数约为6.02×1023个,也可以表示为1NA。
(4)【推理】物质的量、粒子数(符号为N)、阿伏加德罗常数之间的计算关系为:
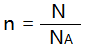
4、物质的量与质量之间的关系
(1)12C的相对原子质量是12,1mol12C的质量是12 g。
【推理】1mol O的质量是多少g?1mol H的质量是多少g?1mol H2O的质量是多少g?
【推理】1mol Na的质量是多少g?1mol Cl的质量是多少g?1mol NaCl的质量是多少g?
(2)摩尔质量:单位物质的量的(1mol)物质具有的质量。符号为M,单位是g/mol(或写为g·mol-1)。
O的摩尔质量是?Na的摩尔质量是?H2O的摩尔质量是?
(3)【推理】物质的量、质量(符号为M)、摩尔质量之间的计算关系为:
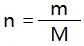
(4)注意:需要记忆常见元素的相对原子质量和常见化合物的相对分子质量。
H2SO4:98 NaHCO3:84 Na2CO3:106 CaCO3:100 AgCl:143.5 BaSO4:233……
二、气体摩尔体积
1、为什么要研究物质的量与气体体积的关系
(1)对于气体来说,测量体积比称量质量更方便。
(2)相等物质的量的气体的体积是相等的。不管哪种气体,只要知道气体的体积,就能很快知道气体的物质的量。
而1mol 不同的液体或固体的体积各不相同,用体积计算物质的量并不方便。
2、物质的量与气体体积之间的计算关系
(1)在0℃和101KPa(标准状况)下,1mol 任何气体的体积都约为22.4L。
在25℃和101KPa(通常状况)下,1mol 任何气体的体积都约为24.5L。
不管是单一气体还是混合气体,都是如此。
(2)气体摩尔体积:单位物质的量(通常用1mol)的气体所占的体积,符号为Vm,单位有L/mol(或写为L·mol-1)等。
气体摩尔体积在一定温度和一定压强下,是定值。在不同的温度和压强下,数值会不同。
标准状况下,气体摩尔体积22.4L·mol-1。
通常状况下,气体摩尔体积24.5L·mol-1。
(3)【推理】气体的物质的量、气体的体积(符号为V)、气体摩尔体积之间的计算关系为:
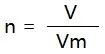
3、气体的混合
(1)气体混合时,体积是加和的。
标准状况下,2mol H2与3mol O2混合,混合后的体积为
2mol×22.4L·mol-1+3mol×22.4L·mol-1=112L
(2)气体混合均匀后,每一小块体积的混合气体中各气体的比例相同,密度相同。
(3)混合气体的平均相对分子质量,求解公式为
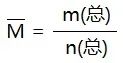
(4)混合气体中某气体的体积分数(符号为φ),求解公式为
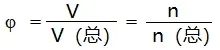
4、阿伏加德罗定律及其它一些定律
(1)阿伏加德罗定律:在相同的温度和压强下,相同体积的任何气体都含有相同数目的粒子。
(2)【推理】推论:
①同温度同压强下,气体的体积比等于物质的量之比。
V1/V2= n1/n2
②同温度同体积时,气体的压强比等于物质的量之比。
P1/P2= n1/n2
③同温度同物质的量时,气体的压强之比与体积之比成反比。
P1/P2= V2/V1
④同温度同压强下,气体的密度比等于摩尔质量(相对分子质量)之比。
ρ1/ρ2= M1/M2
⑤根据理想气体状态方程(克拉珀龙方程)PV=nRT,可以得到更多的推论。
三、物质的量浓度
1、什么是物质的量浓度
(1)什么是浓度?表示物质在某空间或体系中分布浓稀的概念。像混合物中的质量分数、饱和溶液的溶解度、色彩的饱和度等。
(2)为什么要提出物质的量浓度
对于液体,测量体积比称量质量更方便。物质的量浓度可以建立溶液中溶质的物质的量与溶液体积之间的关系。
(3)物质的量浓度表示单位体积的空间中,所含物质的物质的量的多少,符号为c,单位有mol/L(或写为mol·L-1)等。
(4)【推理】溶液中溶质的物质的量、溶液的体积(符号为V)、物质的量浓度之间的计算关系为:
n = c · V
2、溶液的稀释与混合
(1)稀释:
1mol·L-1的H2SO4溶液200mL 加水稀释到500mL,此时H2SO4溶液的物质的量浓度是多少?
根据稀释过程中H2SO4的物质的量不变
1mol·L-1×0.2L=c×0.5L
解得c=0.4 mol·L-1
(2)混合:
1mol·L-1的H2SO4溶液200mL 与2mol·L-1的H2SO4溶液300mL 混合,若混合后的体积为混合前的体积加和,此时H2SO4溶液的物质的量浓度是多少?
根据混合后的物质的量等于混合前的物质的量的加和
c×(0.2L+0.3L)=1mol·L-1×0.2L+2mol·L-1×0.3L
解得c =1.6 mol·L-1
3、关于物质的量浓度的复杂计算
标准状况下aL HCl溶于bmL水中,形成密度为x g·cm-3的盐酸,求HCl的物质的量浓度。
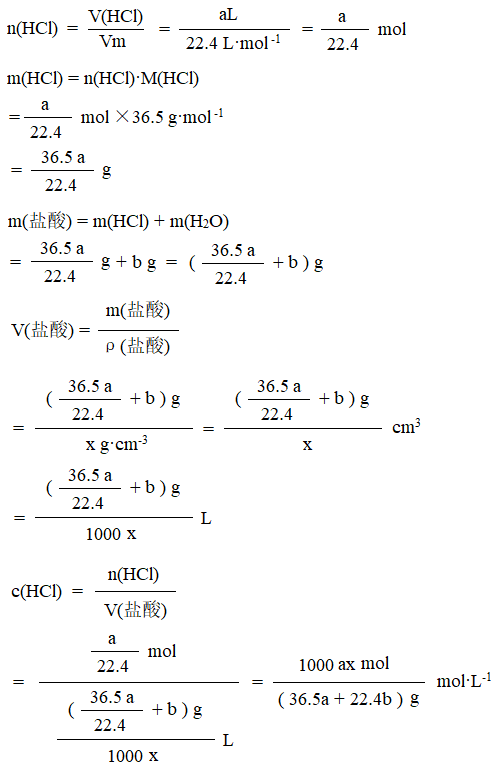
4、配制一定物质的量浓度的溶液
(1)容量瓶的使用注意事项
①容量瓶上标有温度,使用温度与标注温度要一致。
②容量瓶上标有容积。注意实验的要求,选用合适容积的容量瓶。
③容量瓶在使用前要检验是否漏水。
④容量瓶在使用过程中要小心,不要被碰倒,不要让瓶塞被摔坏。
⑤容量瓶不能用于长时间存放溶液。
⑥容量瓶使用后,清洗干净,并在瓶塞与容量瓶之间垫上纸片。
(2)配制100mL1·00mol·L-1的NaCl溶液
不能用0.1mol NaCl加100mL 水的方式配制。因为溶解后溶液的体积不一定是100mL。
要用0.1mol NaCl加水溶解后,继续加水稀释到100mL 为止。具体加了多少mL的水是无需知道的。
步骤如下:
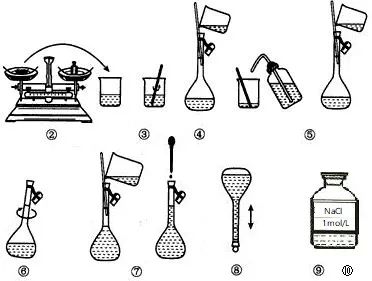
①计算:计算NaCl的质量:m=n·M=0.1mol×58.5g·mol-1=5.85g
②称量:用托盘天平称取NaCl 5.9g。
③溶解:在小烧杯中加入称量好的NaCl,加入一定量水,用玻璃棒搅拌,溶解。
④转移:将小烧杯中的NaCl溶液,用玻璃棒引流到100mL 容量瓶中。
(若用NaOH固体配制NaOH溶液或用浓硫酸配制稀硫酸,转移前需要先冷却至室温)
⑤洗涤并转移:将小烧杯和玻璃棒用水洗涤,将洗涤后的溶液引流到容量瓶中,重复操作2-3次。
⑥摇匀:将容量瓶摇动几下,使溶液混合均匀。
⑦定容:继续在容量瓶中加水到离刻度线1-2cm处,改用胶头滴管加水至刻度线。
⑧摇匀:将容量瓶盖好瓶塞,反复上下颠倒,摇匀。
⑨装瓶:将配制好的溶液倒入清洁干燥的试剂瓶中。
⑩贴签:在标签上写好物质的名称和浓度,贴在试剂瓶上,备用。
【注意】配制2mol·L-1的H2SO4溶液250mL,用密度为1.84g·cm-3,98%的浓硫酸配制。分析操作步骤中的不同。
操作步骤中的变化:②称量:用50mL 量筒量取27.2mL 浓硫酸。
③溶解:在小烧杯中先加入一定量水,再将浓硫酸缓缓倒入,边倒入边用玻璃棒搅拌,溶解。然后静置冷却到室温。
④转移:……用玻璃棒引流到250mL 容量瓶中。
5、配制一定物质的量浓度的溶液可能存在的问题
(1)溶解后,缺少冷却环节。若用热的溶液进行配制,配制后的浓度偏高。原因是热的液体处于膨胀状态。
(2)忘记洗涤并转移。若忘记,配制后的浓度偏低。
(3)定容时加水超过刻度线,只能重新配制。若用胶头滴管吸取过量的溶液,配制后的浓度偏低。
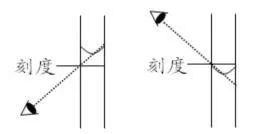
(4)定容时俯视或仰视刻度线。【推理】若俯视刻度线,配制后的浓度偏高。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。绪言 1 、 17 世纪中叶,化学开始走上以 科学实验 为基础的发展道路。 2 、 近代化学...
一、配合物 1 、 CuSO 4 固体是白色的, CuCl 2 固体是棕黄色的, CuBr 2 固体是深褐...
一、金属晶体与金属键 1 、固态的金属都是晶体,称为金属晶体。 金属晶体中,金属原子...
一、共价键 (弄懂共价键的成键过程,对理解大 л 键和杂化轨道很有用) 1 、共价键是...
一、能层与能级 1 、核外电子的分层 核外电子在能量不同的区域内运动,简化为电子层,...
离子、原子、分子之间通过什么作用力形成宏观物质呢? 有些靠化学键,有些靠分子间作...