
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
这节课结合复习氧化还原反应,体会物质的氧化性、还原性,特别是注意训练氧化还原反应产物的书写与方程式的配平,更有意义。
一、Fe
1、铁的存在:
(1)自然界中有单质,来自于陨铁。
(2)主要以+2价和+3价的化合物存在于矿石中。
(3)在地壳中的含量排第四位:O、Si、Al、Fe。
2、物理性质:
纯铁为银白色金属固体。有延展性、导热性、导电性,能被磁铁吸引。
平时看到的黑色铁的表面有四氧化三铁等保护膜。
3、化学性质:(原子结构在选择性必修二中会学到)
反应后呈现+2价、+3价。
(1)【推理】与氧化性强的物质能生成+3价的化合物
2Fe+3Cl2 2FeCl3
2FeCl3
2Fe+3Br2 2FeBr3
2FeBr3
Fe+4HNO3(稀) =Fe(NO3)3+NO↑+2H2O
(2)【推理】与氧化性弱的物质能生成+2价的化合物,如S、I2、稀盐酸或稀硫酸、CuSO4溶液等。
Fe+2HCl=FeCl2+H2↑
Fe+CuSO4=Cu+FeSO4
Fe+S FeS
FeS
Fe+I2 FeI2
FeI2
(3)有时同时生成+2和+3价的化合物,如O2、H2O。
3Fe+2O2 Fe3O4
Fe3O4
【推理与确认】3Fe+4H2O(g) Fe3O4+4H2
Fe3O4+4H2
【实验】铁与水蒸气的反应

铁丝网的作用:聚集火焰,提高加热温度。
什么是还原铁粉,为什么要用还原铁粉?
还原铁粉一般由铁的氧化物用H2或CO还原生成。呈粉末状,微观结构疏松,易于发生反应。
二、铁的氧化物
1、物理性质和俗名
FeO | Fe2O3 | Fe3O4 | |
俗名 | 无 | 铁红 | 磁性氧化铁 |
Fe的价态 | +2 | +3 | +2、+3 |
颜色状态 | 黑色粉末 | 红棕色粉末 | 黑色晶体 |
溶解性 | 难溶于水 | 难溶于水 | 难溶于水 |
特性 | 不稳定 | 很稳定。 | 有磁性。比较稳定。 |
2、化学性质:
从物质类别和元素价态两方面分析物质的化学性质。采用推理的方式写出各方程式。
(1)FeO:【推理】
①碱性氧化物:能与强酸反应。
FeO+H2SO4=FeSO4+H2O
②Fe处于低价态,有还原性。能与强氧化性酸发生氧化还原反应。
3FeO+10HNO3=3Fe(NO3)3+NO↑+5H2O
③不稳定,在空气中受热能迅速被氧化为Fe3O4。
6FeO+O2 2Fe3O4
2Fe3O4
(2)Fe2O3:【推理】
①碱性氧化物:能与强酸反应。
Fe2O3+6HCl=2FeCl3+3H2O
②Fe处于高价态,有氧化性。能与强还原性酸发生氧化还原反应。
Fe2O3+6HI=2FeI2+I2+3H2O
(3)Fe3O4:【推理】复杂氧化物,相当于FeO:Fe2O3=1:1形成的化合物。自然界中的Fe3O4很难与酸反应。
①不能叫碱性氧化物:能与强酸反应。
Fe3O4+8HCl=FeCl2+2FeCl3+4H2O
②Fe既有低价态,又有高价态,既有还原性,又有氧化性。能与强氧化性酸或强还原性酸发生氧化还原反应。
Fe3O4+8HI=3FeI2+I2+4H2O
3Fe3O4+28HNO3=9Fe(NO3)3+NO↑+14H2O
在潮湿环境中慢慢被空气中氧气氧化为Fe2O3。
4Fe3O4+O2=6Fe2O3
(4)高炉炼铁的反应:
Fe2O3+3CO 2Fe+3CO2
2Fe+3CO2
其它的铁的氧化物也能被H2或CO还原为Fe。
三、铁的氢氧化物
1、物理性质
Fe(OH)2:白色固体,难溶于水。
Fe(OH)3:红褐色固体,难溶于水。
2、化学性质
(1)Fe(OH)2【推理】
①弱碱,与强酸能反应。Fe(OH)2+H2SO4=FeSO4+2H2O
②Fe处于低价态,有还原性。能与强氧化性酸发生氧化还原反应。
3Fe(OH)2+10HNO3=3Fe(NO3)3+NO↑+8H2O
③Fe(OH)2不稳定,在空气中反应比较复杂。
(2)Fe(OH)3【推理】
①弱碱,与强酸能反应。Fe(OH)3+3HCl=FeCl3+3H2O
②Fe处于高价态,有氧化性。能与强还原性酸发生氧化还原反应。
2Fe(OH)3+6HI=2FeI2+I2+6H2O
③Fe(OH)3不稳定,受热易分解。
2Fe(OH)3=Δ= Fe2O3+3H2O
3、【实验】制取Fe(OH)3、Fe(OH)2

(1)制取Fe(OH)3:用可溶性+3价Fe的盐与强碱反应制取。
FeCl3+3NaOH=Fe(OH)3↓+3NaCl
【先推理,再验证】现象:有红褐色沉淀生成。
(2)制取Fe(OH)2:用可溶性+2价Fe的盐与强碱反应制取。
FeSO4+2NaOH=Fe(OH)2↓+Na2SO4
【先推理,再发现问题】现象:有白色沉淀生成,生成的白色沉淀迅速变成灰绿色,一段时间后沉淀出现红褐色。
Fe(OH)2会被水中溶解的氧气氧化:4Fe(OH)2+O2+2H2O=4Fe(OH)3
(3)如何在水溶液中制取比较稳定的Fe(OH)2?
【探究并设计】:用有机液体隔离空气与水溶液的接触,溶液中溶解氧的减少,用非氧化性气体除去周围的空气……
思考下面这些设计是如何达成目的的?
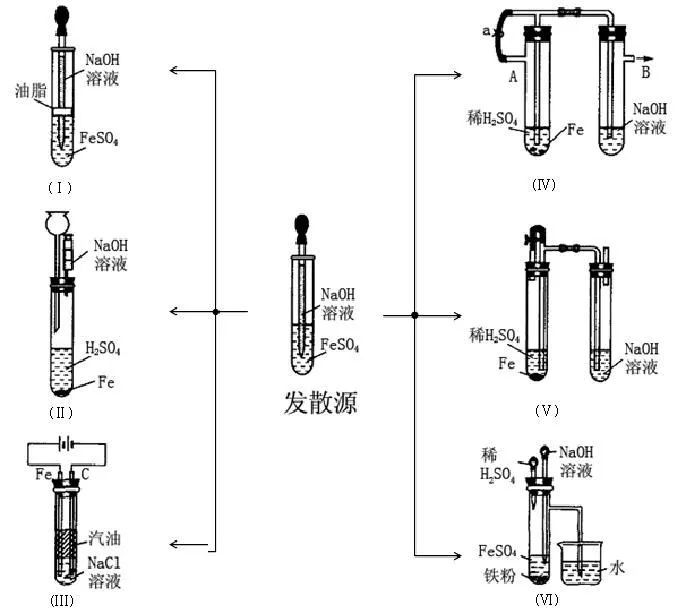
四、铁的盐
1、铁的盐包括Fe2+对应的盐,如FeCl2、FeSO4、Fe(NO3)2等。Fe3+对应的盐,如FeCl3、Fe2(SO4)3、Fe(NO3)3等。它们的性质,主要考虑的是Fe2+、Fe3+的性质。
2、主要化学性质
(1)【推理】强碱制弱碱
都与NaOH等强碱反应
Fe2++2OH-=Fe(OH)2↓
Fe3++3OH-=Fe(OH)3↓
(2)【推理】Fe3+具有较强的氧化性,在水溶液中容易发生氧化还原反应。
①与金属反应:
与比铁活泼性差的金属反应生成Fe2+:2Fe3++Cu=2Fe2++Cu2+。
与比铁活泼性强的金属反应生成Fe:Fe3++Al=Fe+Al3+。
应用:用Fe3+溶液溶解覆铜板。
②【背景知识】C、H2与Fe3+不反应。它们在水溶液中很难反应,一般只在气态或固态环境下反应。
③与HI溶液、KI溶液等含I(-1价)物质的反应:2Fe3++2I-= 2Fe2++I2。
④与SO2、NaHSO3溶液、Na2SO3溶液等含S(+4价)物质的反应:2Fe3++SO32-+H2O= 2Fe2++SO42-+2H+。
⑤与H2S、NaHS溶液、Na2S溶液等含S(-2价)物质的反应:2Fe3++S2-= 2Fe2++S↓。
(3)【推理】Fe2+具有较强的还原性,在水溶液中容易发生氧化还原反应。
①与Cl2反应:2Fe2++Cl2=2Fe3++2Cl-。
②与O2反应:
【背景知识】O2-在水溶液中不存在,在酸性溶液中会和2H+生成H2O,在中性或碱性溶液中会和H2O生成2OH-。
在强酸性环境中:4Fe2++4H++O2=4Fe3++2H2O。
只在盐溶液环境中:12Fe2++6H2O+3O2= 8Fe3++4Fe(OH)3↓。
③与H2O2反应:
在强酸性环境中:2Fe2++2H++H2O2=2Fe3++2H2O。
只在盐溶液环境中:6Fe2++3H2O2=4Fe3++2Fe(OH)3↓。
④与稀HNO3反应:3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O。
⑤与酸性KMnO4溶液反应:5Fe2++8H++MnO4-=5Fe3++Mn2++4H2O。
(4)Fe2+有一定的氧化性,在水溶液中能与容易发生氧化还原反应。
与Mg反应:Fe2++Mg=Fe+ Mg2+。
3、与CO32-等是否生成沉淀?
Fe2+、Fe3+的强酸盐与CO32-等会生成沉淀。但生成沉淀的反应不是简单地生成难溶盐的反应,而是主要发生双水解反应。(关于双水解的知识在选择性必修一的第三章学习)
4、如何检验Fe2+、Fe3+?
(1)检验Fe3+:

FeCl3溶液(左)与加入硫氰化钾之后的溶液(右)
①【实验】用硫氰化钾(KSCN)溶液检验:遇Fe3+溶液变红色,这种方法是高中化学中最常用的方法。
②用NaOH溶液检验:生成红褐色沉淀。
用铁氰化钾检验Fe2+在选择性必修一第四章中学习,在此处不用介绍。
(2)检验Fe2+:
①【实验】用硫氰化钾(KSCN)溶液和氧化剂组合检验:先加KSCN,溶液不变色,再加氧化剂(Cl2、稀HNO3、双氧水等)溶液变红色。
②用NaOH溶液检验:生成白色沉淀,然后沉淀迅速变为灰绿色,最后沉淀变为红褐色。
③用酸性KMnO4溶液检验:溶液紫色褪去,出现棕黄色。
从灵敏度上考虑,Fe2+、Fe3+用KSCN检验比用NaOH溶液检验更好。
(3)应用:菠菜中铁离子的检验。(其它一些物质中铁离子的检验也是这种方法)
①将菠菜研磨,加水溶解,过滤。
②将得到的滤液中加少量稀HNO3,再加KSCN溶液,看现象。
5、高铁酸盐的生成、性质和用途在此处可以不用介绍,学习选择性必修一第三章时介绍即可。
五、关于铁及化合物的过量问题
1、过量铁与浓硝酸反应
(1)铁与浓硝酸在常温下发生钝化现象,在加热下才会反应。
Fe+6HNO3(浓) Fe(NO3)3+3NO2↑+3H2O
Fe(NO3)3+3NO2↑+3H2O
(2)当硝酸变稀时,反应变为铁与稀硝酸的反应。
Fe+4HNO3(稀)=Fe(NO3)3+NO↑+2H2O
(3)当变为更稀的硝酸时,硝酸的产物还会有变化,如生成N2、NH4NO3等。(考查时一般会忽略这个反应过程)
(4)最后发生铁与硝酸铁的反应。
Fe+2Fe(NO3)3=3Fe(NO3)2
2、过量铁与稀硝酸反应
(1)先发生铁与稀硝酸的反应。
(2)当变为更稀的硝酸时,硝酸的产物还会有变化。(考查时一般会忽略这个反应过程)
(3)最后发生铁与硝酸铁的反应。
所以,调整Fe的量溶液中会发生下列两个总反应:(忽略其它还原产物的生成)
Fe+4HNO3(稀,过量)=Fe(NO3)3+NO↑+2H2O
3Fe+8HNO3(稀,少量)=3Fe(NO3)2+2NO↑+4H2O
3、FeBr2溶液中通入过量Cl2反应
【背景知识】Fe2+的还原性大于Br-的,两者都能被Cl2氧化。
(1)随着Cl2的通入,溶液中先发生Fe2+与Cl2的反应。
2Fe2++Cl2=2Fe2++2Cl-
(2)再发生Br-与Cl2的反应。
2Br-+Cl2=Br2+2Cl-
所以,调整Cl2的量溶液中会发生下列两个总反应:
2Fe2++Cl2(少量)=2Fe3++2Cl-
【化学方程式为:6FeBr2+3Cl2(少量)= 4FeBr3+2FeCl3】
2Fe2++4Br-+3Cl2(过量)=2Fe3++2Br2+6Cl-
【化学方程式为:2FeBr2+3Cl2(过量)= 2FeCl3+2Br2】
此过量问题中Cl2过量时的离子方程式书写容易出问题,Fe2+和Br-要按个数比1:2书写,才是正确的。
4、FeI2溶液中通入过量Cl2反应
【背景知识】I-的还原性大于Fe2+的,两者都能被Cl2氧化。
(1)随着Cl2的通入,溶液中先发生I-与Cl2的反应。
2I-+Cl2=I2+2Cl-
(2)再发生Fe2+与Cl2的反应。
2Fe2++Cl2=2Fe2++2Cl-
所以,调整Cl2的量溶液中会发生下列两个总反应:
2I-+Cl2(少量)= I2+2Cl-
【化学方程式为:FeI2+Cl2(少量)= FeCl2+I2】
2Fe2++4I-+3Cl2(过量)=2Fe3++2I2+6Cl-
【化学方程式为:2FeI2+3Cl2(过量)= 2FeCl3+2I2】
由于过量的Cl2在溶液中还可以与I2继续反应,所以FeI2溶液与Cl2反应的过量问题,考查的可能性在减少。
5、Fe(NO3)3溶液中滴入稀HI溶液
(1)先发生的离子反应为:
Fe3++NO3-+4H++4I-=Fe2++NO↑+2I2+2H2O
(2)后发生的离子反应为:
2NO3-+8H++6I-=2NO↑+3I2+4H2O
所以,调整HI的量溶液中会发生下列两个总反应:
Fe3++NO3-+4H++4I-(少量)=Fe2++NO↑+2I2+2H2O
【化学方程式为:Fe(NO3)3+4HI(少量)= Fe(NO3)2+NO↑+2I2+2H2O】
Fe3++3NO3-+12H++10I-(过量)=Fe2++3NO↑+5I2+6H2O
【化学方程式为:Fe(NO3)3+12HI(过量)= FeI2+3NO↑+5I2+6H2O】

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。绪言 1 、 17 世纪中叶,化学开始走上以 科学实验 为基础的发展道路。 2 、 近代化学...
一、配合物 1 、 CuSO 4 固体是白色的, CuCl 2 固体是棕黄色的, CuBr 2 固体是深褐...
一、金属晶体与金属键 1 、固态的金属都是晶体,称为金属晶体。 金属晶体中,金属原子...
一、共价键 (弄懂共价键的成键过程,对理解大 л 键和杂化轨道很有用) 1 、共价键是...
一、能层与能级 1 、核外电子的分层 核外电子在能量不同的区域内运动,简化为电子层,...
离子、原子、分子之间通过什么作用力形成宏观物质呢? 有些靠化学键,有些靠分子间作...