
|
学习小专题 |

|
学习小专题 |
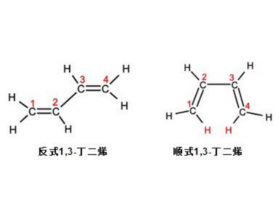 [教材分析] 回归课本:需要特殊注意的教材内容之有机化学基础 作者:张德金 来源:未知 日期:2025-04-10 09:13:42 点击:289 所属专题:有机化学基础
[教材分析] 回归课本:需要特殊注意的教材内容之有机化学基础 作者:张德金 来源:未知 日期:2025-04-10 09:13:42 点击:289 所属专题:有机化学基础
引言 1 、 1828 年,化学家 维勒 发现无机化合物氰酸铵( NH 4 OCN )通过加热可以直接转变为有机化合物尿素【 CO(NH 2 ) 2 】。化学方程式为: NH 4 OCN→Δ→CO(NH 2 ) 2 第一章有机化合物的结构特点与研究方法 1 、范托夫与 碳价四面体学说 荷兰化学家 范托夫 于 1874 ...
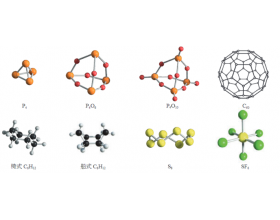 [教材分析] 回归课本:需要特殊注意的教材内容之物质结构与性质 作者:张德金 来源:未知 日期:2025-04-10 09:32:01 点击:143 所属专题:物质结构与性质
[教材分析] 回归课本:需要特殊注意的教材内容之物质结构与性质 作者:张德金 来源:未知 日期:2025-04-10 09:32:01 点击:143 所属专题:物质结构与性质
引言 1 、古希腊曾盛行一种叫做 “ 原性论 ” 的哲学,把世界万物的本原归结为四种基本性质 —— 冷、热、干、湿 ;它们两两结合,便形成四种基本元素 —— 土、水、气、火 ;四种元素再按不同比例结合,便得到世间万物。 原性论认为物质的性质与变化决定了物质的组成与...
 [教材分析] 回归课本:需要特殊注意的教材内容之化学反应原理 作者:张德金 来源:未知 日期:2025-04-10 09:36:12 点击:338 所属专题:化学反应原理
[教材分析] 回归课本:需要特殊注意的教材内容之化学反应原理 作者:张德金 来源:未知 日期:2025-04-10 09:36:12 点击:338 所属专题:化学反应原理
第一章 化学反应的热效应 1 、燃烧热中的生成指定产物:碳元素变为 CO 2 (g) ,氢元素变为 H 2 O(l) ,硫元素变为 SO 2 (g) ,氮元素变为 N 2 (g) ,磷元素变为 P 2 O 5 (s) ,卤族元素变为 HX(g) 等。 2 、研究与实践:了解火箭推进剂 ( 1 )液氢和液氧。 ( 2 )混肼 -5...
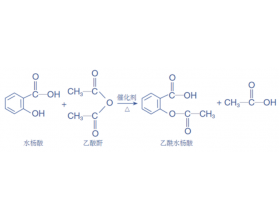 [教材分析] 回归课本:需要特殊注意的教材内容之必修二 作者:张德金 来源:未知 日期:2025-04-10 09:59:23 点击:229 所属专题:必修二
[教材分析] 回归课本:需要特殊注意的教材内容之必修二 作者:张德金 来源:未知 日期:2025-04-10 09:59:23 点击:229 所属专题:必修二
第五章 化工生产中的重要非金属元素 1 、几种硫酸盐 ( 1 )硫酸钙:自然界中的硫酸钙常以 石膏 ( CaSO 4 ·2H 2 O )的形式存在。石膏被加热到 150°C 时,会失去所含大部分结晶水而变成 熟石膏 ( 2CaSO 4 ·H 2 O )。熟石膏与水混合成糊状物后会很快凝固,重新变成石膏。...
 [教材分析] 回归课本:需要特殊注意的教材内容之必修一 作者:张德金 来源:未知 日期:2025-04-10 07:46:22 点击:155 所属专题:必修一
[教材分析] 回归课本:需要特殊注意的教材内容之必修一 作者:张德金 来源:未知 日期:2025-04-10 07:46:22 点击:155 所属专题:必修一
绪言 1 、 17 世纪中叶,化学开始走上以 科学实验 为基础的发展道路。 2 、 近代化学发展的几个重要里程碑: ( 1 ) 1661 年,英国化学家 波义耳 提出 元素 的概念,标志着近代化学的诞生。 ( 2 ) 1774 年,法国化学家 拉瓦锡 提出 燃烧的氧化学说 ,使近代化学取得了革命性...
 [教材分析] 教材分析(物质结构与性质):配合物与超分子 作者:张德金 来源:未知 日期:2023-09-04 16:44:31 点击:935 所属专题:配合物 超分子
[教材分析] 教材分析(物质结构与性质):配合物与超分子 作者:张德金 来源:未知 日期:2023-09-04 16:44:31 点击:935 所属专题:配合物 超分子
一、配合物 1 、 CuSO 4 固体是白色的, CuCl 2 固体是棕黄色的, CuBr 2 固体是深褐色的。 它们的稀的水溶液为什么都是蓝色的? 溶液呈蓝色的原因是,溶液中存在四水合铜离子,可表示为 [Cu(H 2 O) 4 ] 2+ 。 在四水合铜离子中,水分子与铜离子之间的作用力是什么呢? ...
 [教材分析] 教材分析(物质结构与性质):金属晶体与离子晶体 作者:张德金 来源:未知 日期:2023-09-04 16:41:52 点击:1500 所属专题:金属晶体 离子晶体
[教材分析] 教材分析(物质结构与性质):金属晶体与离子晶体 作者:张德金 来源:未知 日期:2023-09-04 16:41:52 点击:1500 所属专题:金属晶体 离子晶体
一、金属晶体与金属键 1 、固态的金属都是晶体,称为金属晶体。 金属晶体中,金属原子以紧挨的形式层层堆积。 不同的金属堆积方式有所不同,有简单立方、体心立方(钾型)、面心立方(铜型)、六方(镁型)等堆积方式。 关于金属晶体的空间利用率和密度计算,在前面的《...
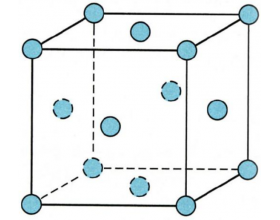 [教材分析] 教材分析(物质结构与性质):分子晶体与共价晶体 作者:张德金 来源:未知 日期:2023-09-04 16:22:30 点击:1049 所属专题:分子晶体 共价晶体
[教材分析] 教材分析(物质结构与性质):分子晶体与共价晶体 作者:张德金 来源:未知 日期:2023-09-04 16:22:30 点击:1049 所属专题:分子晶体 共价晶体
一、分子晶体 1 、只含分子的晶体称为分子晶体。 分子晶体中分子之间靠分子间作用力相互吸引。由于分子间作用力较小,所以分子晶体的熔沸点较低,硬度也较...
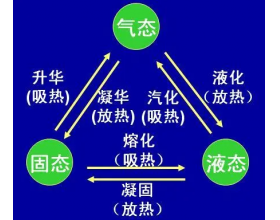 [教材分析] 教材分析(物质结构与性质):物质的聚集状态与晶体的常识 作者:张德金 来源:未知 日期:2023-09-04 16:14:18 点击:779 所属专题:晶胞
[教材分析] 教材分析(物质结构与性质):物质的聚集状态与晶体的常识 作者:张德金 来源:未知 日期:2023-09-04 16:14:18 点击:779 所属专题:晶胞
一、物质的聚集状态 物质的三态有固态、液态、气态。它们之间的转化关系如下 在三态的组成物质中,既有分子,也有离子或原子。 有离子的气态物质,如等离子体。 等离子体是由阳离子、电子、电中性粒子(分子或原子)组成,整体上呈电中性的气态物质。 二、晶体与非晶体 ...
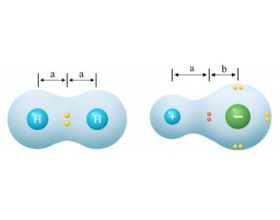 [教材分析] 教材分析(物质结构与性质):分子结构与物质的性质 作者:张德金 来源:未知 日期:2023-09-04 16:11:19 点击:452 所属专题:分子性质
[教材分析] 教材分析(物质结构与性质):分子结构与物质的性质 作者:张德金 来源:未知 日期:2023-09-04 16:11:19 点击:452 所属专题:分子性质
键的极性和分子的极性会物质的物理性质和化学性质。 一、共价键的极性 1 、键的极性和分子的极性 ( 1 )共价键分为极性键和非极性键。 极性键:组成键的两个原子不相同,共用电子对会发生偏移,偏离的原子显正电性,偏向的原子显负电性,整个键显极性。 H δ + : Cl δ...
 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。绪言 1 、 17 世纪中叶,化学开始走上以 科学实验 为基础的发展道路。 2 、 近代化学...
一、配合物 1 、 CuSO 4 固体是白色的, CuCl 2 固体是棕黄色的, CuBr 2 固体是深褐...
一、金属晶体与金属键 1 、固态的金属都是晶体,称为金属晶体。 金属晶体中,金属原子...
一、共价键 (弄懂共价键的成键过程,对理解大 л 键和杂化轨道很有用) 1 、共价键是...
一、能层与能级 1 、核外电子的分层 核外电子在能量不同的区域内运动,简化为电子层,...
离子、原子、分子之间通过什么作用力形成宏观物质呢? 有些靠化学键,有些靠分子间作...
一、铝合金 1 、铝 ( 1 ) Al 的物理性质:银白色金属。导电能力好,是导电的主要材...
这节课结合复习氧化还原反应,体会物质的氧化性、还原性,特别是注意训练氧化还原反应...