
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
一、分子晶体
1、只含分子的晶体称为分子晶体。
分子晶体中分子之间靠分子间作用力相互吸引。由于分子间作用力较小,所以分子晶体的熔沸点较低,硬度也较小。下面是一些分子晶体的熔点
| 分子晶体 | 熔点/℃ |
氧气 | -218.3 |
氮气 | -210.1 |
白磷 | 44.2 |
甲烷 | -182 |
硫化氢 | -85.6 |
水 | 0 |
乙酸 | 16.6 |
尿素 | 132.7 |
2、常见的由分子构成的晶体有
(1)除金刚石、石墨、B、Si、Ge等之外的非金属单质。如I2、S8、P4、C60等。
(2)所有非金属氢化物。如冰等。
(3)除SiO2等之外的大多数非金属氧化物。如P4O10、干冰(CO2)等。
(4)几乎所有的酸。如冰醋酸、苯酚等。
(5)绝大多数有机物。如葡萄糖、蔗糖等。
3、分子晶体的结构
(1)分子密堆积
多数分子晶体的晶胞为面心立方结构。
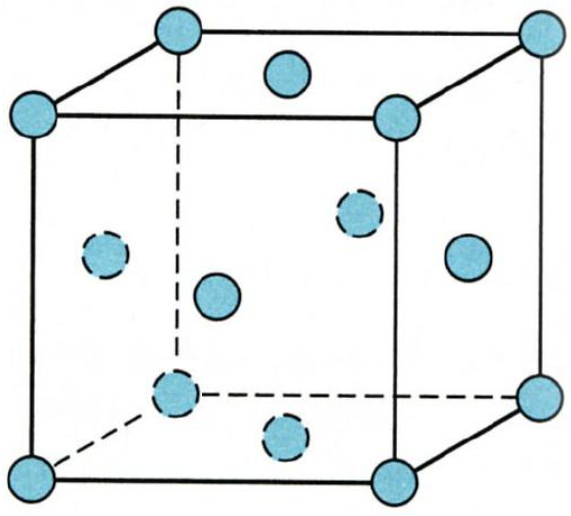
像干冰、I2、C60等。
注意的是分子之间并不是原子和原子紧挨在一起,有一定的距离。分子和分子之间主要靠范德华力相互作用。
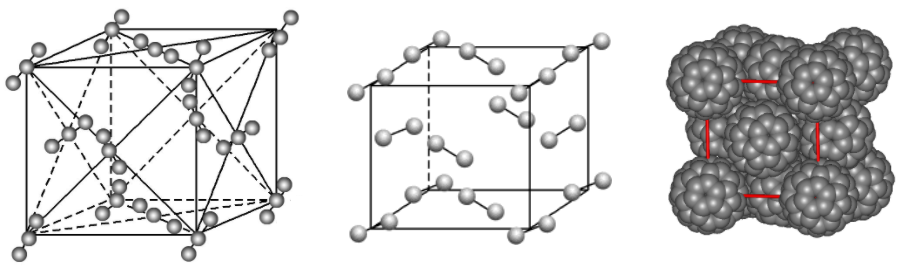
(2)冰的特殊结构
由于水分子之间的主要作用力是氢键,而氢键有方向性,冰分子的结构并不是分子密堆积结构。
冰的这一排列使冰晶体中的水分子的空间利用率降低,其密度比液态水的小。
(3)干冰的外观像冰,硬度也像冰,但熔点比冰低的多,在常压下极易升华。这是由于干冰中的CO2分子之间的作用力为范德华力,比冰中的H2O分子之间的作用力氢键要小。
但干冰的密度比冰的密度要大。这是由于范德华力没有方向性,CO2分子之间没有形成很大的空隙。

二、共价晶体
1、共价晶体指相邻原子间以共价键相结合形成的具有空间立体网状结构的晶体。
晶体中没有分子。原子之间以共价键相结合,共价键之间有方向性,饱和性。
由于共价键的作用力很强,所以共价晶体的熔沸点很高。由于共价键有方向性和饱和性,有些共价晶体的密度不高。
2、常见的共价晶体有哪些:
(1)碳族元素的单质中有:金刚石、硅、锗、灰锡。
(2)硼。
(3)关于硅、氮、硼的一些化合物:SiO2、SiC、Si3N4、BN、AlN等。
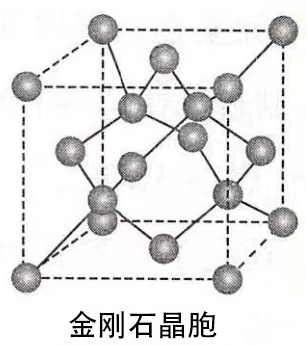
3、金刚石晶体的结构
(1)每个碳原子以四个共价单键对称地与相邻的4个碳原子结合,C-C-C夹角为109°28’。
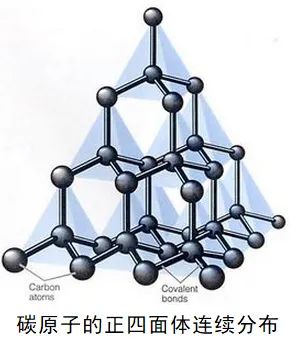
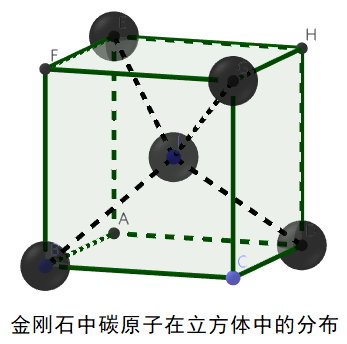
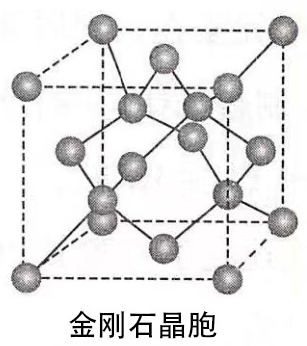
(2)由于C原子的半径小,键长短,键能大,所以金刚石的熔点很高,硬度很大。
(3)晶体硅、SiC、BN、SiO2等有些晶体的结构也和金刚石类似。
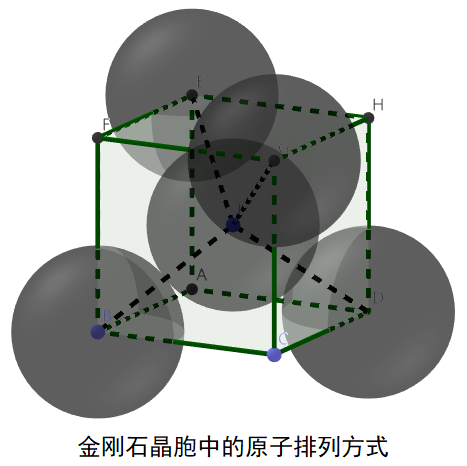
(4)金刚石晶体的空间占用率计算和密度计算:
可以用金刚石晶胞中的原子排列方式图进行计算。
①空间占用率的计算:
图中的原子数目计算:8×1/8+6×1/2+4=8。
空间利用率计算:在体心立方中,设为球半径为r,
则正方体的体对角线为8r。(为什么?)
又因为正方体的体对角线是边长的√3倍,则边长为8r /√3。
原子的总体积为8×4πr3/3,正方体的体积为512r3/3√3。
空间利用率为(8×4πr3/3)/(512r3/3√3)=π√3/16= 34.01%
②密度的计算
金刚石晶体中C原子的共价半径为77pm。
m=nm(C)=8×12/NA g =96/NAg
V=(8×77×10-10cm /√3)3= 4.50×10-23cm3
ρ=m/V
= (96/NAg) /(4.50×10-23cm3)
=3.54 g/cm3
这个数据与实际数据很接近。
4、SiO2的结构
它是共价晶体,熔点较高。最常见的是低温石英(а-石英),它的结构如下图
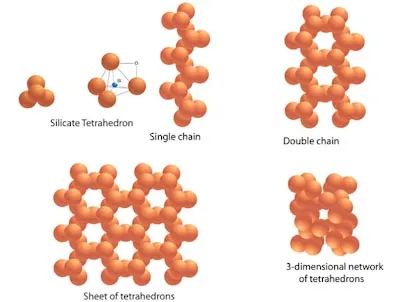
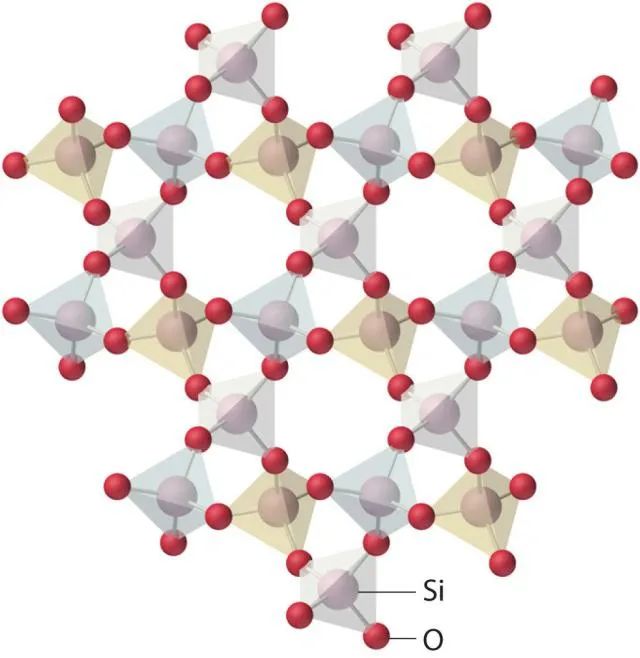
在石英的结构中有顶角相连的硅氧四面体形成螺旋上升的长链,没有封闭的环状结构,它的结构具有手性,可用作压电材料,制作石英手表。
SiO2可用制造水泥、玻璃、人造红宝石、单晶硅、硅光电池、芯片、光导纤维等。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。绪言 1 、 17 世纪中叶,化学开始走上以 科学实验 为基础的发展道路。 2 、 近代化学...
一、配合物 1 、 CuSO 4 固体是白色的, CuCl 2 固体是棕黄色的, CuBr 2 固体是深褐...
一、金属晶体与金属键 1 、固态的金属都是晶体,称为金属晶体。 金属晶体中,金属原子...
一、共价键 (弄懂共价键的成键过程,对理解大 л 键和杂化轨道很有用) 1 、共价键是...
一、能层与能级 1 、核外电子的分层 核外电子在能量不同的区域内运动,简化为电子层,...
离子、原子、分子之间通过什么作用力形成宏观物质呢? 有些靠化学键,有些靠分子间作...