
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!





(四)晶体结构模型——金刚石
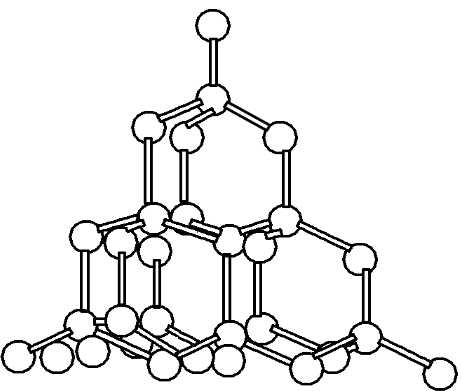
①在晶体中每个碳原子以4个共价键与相邻的4个碳原子相结合,成为正四面体。
②晶体中C—C键夹角为109°28′,碳原子采取了sp3杂化。
③最小环上有6个碳原子。
④晶体中碳原子个数与C—C键数之比为:1∶(4×)=1∶2。
三、分子晶体和原子晶体的比较
晶体类型 | 共价晶体 | 分子晶体 |
含义 | 相邻原子间以共价键相结合而形成空间网状结构的晶体 | 只含分子的晶体 |
组成粒子 | 原子,整块晶体是一个三维的共价键网状结构,不存在单个小分子,是一个“巨分子”,又称共价晶体。 | 分子 |
粒子间作用力 | 共价键 | 分子间作用力 |
熔点 | 很高 | 较低 |
很大 | 较小 | |
溶解性 | 一般不溶于各种溶剂 | 部分溶于水 |
导电性 | 不导电,个别为半导体 | 不导电,部分水溶液导电 |
熔化时破坏的作用力 | 破坏共价键 | 破坏分子间作用力 |
举例 | 金刚石、二氧化硅等 | 冰、干冰等 |
四、分子晶体与共价晶体熔、沸点高低比较
(1)不同类型的晶体
共价晶体>分子晶体。
(2)同一类型的晶体
①分子晶体
A.分子间作用力越大,物质的熔、沸点越高;具有氢键的分子晶体,熔、沸点反常的高。如H2O>H2Te>H2Se>H2S。
B.组成和结构相似的分子晶体,相对分子质量越大,熔、沸点越高。如SnH4>GeH4>SiH4>CH4。
C.组成和结构不相似的物质(相对分子质量接近),分子的极性越大,其熔、沸点越高。如CO>N2,CH3OH>CH3CH3。
D.同分异构体,支链越多,熔、沸点越低。
②共价晶体
晶体的熔、沸点高低取决于共价键的键长和键能。键长越短,键能越大,共价键越稳定,物质的熔、沸点越高。如熔点:金刚石>碳化硅>晶体硅。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。...
一、金属晶体与金属键 1 、固态的金属都是晶体,称为金属晶体。 金属晶体中,金属原子...
一、分子晶体 1 、只含分子的晶体称为分子晶体。 分子晶体中分子之间靠分子间作用力相...
一、物质的聚集状态 物质的三态有固态、液态、气态。它们之间的转化关系如下 在三态的...
(四) 晶体结构模型 —— 金刚石 ①在晶体中每个碳原子以 4 个共价键 与 相邻的 4 个...
...