
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
一、有关概念
1.物质的量
(1)概念:表示物质所含微粒数目多少的物理量
(2)符号:n
(3)单位:mol
2.摩尔
(1)概念:摩尔是物质的量的单位,每1mol物质含有阿伏加德罗常数个结构微粒。
(2)符号:mol
(3)说明:
①当描述物质的物质的量(使用摩尔)时,必须指明物质微粒的名称,不能是宏观物质名称
②常见的微观粒子有:分子、原子、离子、电子、质子、中子或它们特定的组合
③当有些物质的微观粒子只有一种时,可以省略其名称
3.阿伏加德罗常数
(1)含义:实验测定12g12C中碳原子的个数
(2)符号:NA
(3)单位:个/mol
(4)说明:
①NA的基准是12g碳-12中的原子个数
②12C不仅是摩尔的基准对象,而且还是相对原子质量的基准③NA是一个实验值,现阶段常取6.02×1023作计算
④要注意NA与6.02×1023的区别
4.摩尔质量
(1)概念:单位物质的量的物质的质量
(2)符号:M
(3)单位:g·mol-1
(4)说明:
①使用范围:
A.任何一种微观粒子
B.无论是否纯净
C.无论物质的状态
②与式量的比较:
③与1mol物质的质量的比较:
5.气体摩尔体积
(1)概念:单位物质的量的气体的体积
(2)符号:Vm
(3)单位:L·mol-1
(4)标准状况下的气体摩尔体积
①标准状况:0℃、1atm即1.01×105Pa
②理想气体:
A.不计大小但计质量
B.不计分子间的相互作用
③标准状况下的气体摩尔体积:约22.4L·mol-1
(5)影响物质体积大小的因素:
①构成物质的微粒的大小(物质的本性)
②结构微粒之间距离的大小(温度与压强来共同决定)
③结构微粒的多少(物质的量的大小)
6.物质的量浓度
(1)概念:用单位体积的溶液中溶解溶质的物质的量的多少来表示溶液的浓度
(2)符号:c
(3)单位:mol·L-1
(4)说明:①物质的量浓度是溶液的体积浓度
②溶液中的溶质既可以为纯净物又可以为混合物,还可以是指某种离子或分子
二、有关计算关系
1. m、n、N之间的计算关系
(1)计算关系:
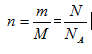
(2)使用范围:只要物质的组成不变,无论是何状态都可以使用
2.V、n、N之间的计算关系
(1)计算关系:
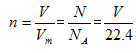
(2)使用范围:
①适用于所有的气体,无论是纯净气体还是混合气体
②当气体摩尔体积用22.4L·mol-1时必须是标准状况
3.c、m、V、N之间的计算关系
(1)计算关系:
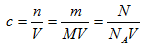
(2)使用范围:
①以上计算关系必须是在溶液中使用
②微粒数目是指某种溶质
③若溶液是由气体溶解于水形成的,要特别注意以下几点:
A.必须根据定义表达式进行计算
B.氨水中的溶质主要是NH3·H2O,但要以NH3为准计算
C.溶液的体积不能直接用气体的体积或水的体积或气体与水的体积之和,而必须是通过
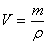
计算得到
4.c、w%、ρ之间的计算关系
(1)计算关系:
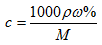
(2)使用范围:同一种溶液的质量分数与物质的量浓度之间的换算
(3)推断方法:
①根据物质的量浓度的定义表达式
②溶质的物质的量用下式计算
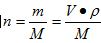
③注意溶液体积的单位
5. 混合气体的平均分子量的有关计算
(1)计算依据:
①1mol任何物质的质量(以g为单位)在数值上与其式量相等
②1mol任何气体的体积(以L为单位)在数值上与气体摩尔体积(以L·mol-1为单位)相等
(2)基本计算关系:
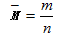
(3)变换计算关系:
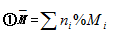
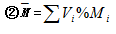
(4)使用说明:
①(2)的计算式适用于所有的混合物的计算
②(3)中的计算式只适用与混合气体的有关计算
③(3)中的两个计算式之间应用了阿伏加德罗定律
6.密度与相对密度
(1)密度
①计算表达式:
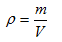
②使用说明:
A.适用于所有的物质,不受物质状态的限制,也适用于所有的混合物
B.所有物质:
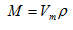 ,
,
标准状况下气体
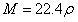
(2)相对密度
①计算表达式:
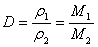
②使用说明:
A.相对密度是在同温同压下两种气体的密度之比
B.既可以用于纯净气体之间的计算,也可以用于混合气体之间
有关规律:阿伏加德罗定律及其推论
(1)标准状况下的气体摩尔体积
①标准状况是指:0℃和1.01×105Pa
②标准状况下1mol任何气体的体积都约为22.4L
(2)气体摩尔体积
①温度和压强一定时,1mol任何气体的体积都约为一个定值
②说明了温度和压强以及气体的物质的量共同决定了气体的体积,而气体分子本身的大小对气体体积的影响很小
③气体摩尔体积比标准状况下气体摩尔体积的范围广
(3)阿伏加德罗定律
①阿伏加德罗定律:同温同压下相同体积的任何气体都具有相同的分子数
②阿伏加德罗定律依然是忽略了气体分子本身的大小
③阿伏加德罗定律比气体摩尔体积的应用更为广泛:
A.主要是应用于不同气体之间的比较,也可以同一种气体的比较
B.被比较的气体既可以是纯净气体又可以是混合气体
(4)克拉珀珑方程
①克拉珀珑方程又称为理想气体的状态方程,它同样忽略了气体分子本身的大小
②克拉珀珑方程:
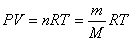
③克拉珀珑方程的变形:
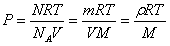
④克拉珀珑方程比阿伏加得罗定律更准确的描述了气体的压强、体积、物质的量和温度之间的关系,其应用范围更广:
A.可以做单一气体的计算
B.可以做不同气体的比较计算
C.计算以及比较计算的条件还可以不同
(5)阿伏加德罗定律的重要的四个推论
①压强之比
A.算式推导:
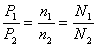
B.语言表达:同温同体积时,任何气体的压强之比都等于其物质的量之比,也等于其分子数之比
②体积之比
A.算式推导:
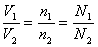
B.语言表达:同温同压时,任何气体的体积之比都等于其物质的量之比,也等于其分子数之比
③质量之比
A.算式推导:
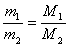
B.语言表达:同温同压同体积时,任何气体的质量之比都等于其摩尔质量之比,也就是其式量之比
④密度之比
A.算式推导:
①
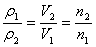
②
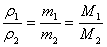
B.语言表达:
①A.相同质量的任何气体的密度之比都等于其体积的反比
B.同温同压下等质量的任何气体的密度之比都等于
其物质的量的反比,也就是其分子个数之比
②A.同体积的任何气体的密度之比都等于其质量之比
B.同温同压同体积时,任何气体的密度之比都等于其摩尔质量之比,也就是其式量之比

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。一、物质的量 1 、为什么引入物质的量,为什么不直接用数目来描述微观粒子,非要增加...
“物质的量”及其单位,是中学化学中十分重要的概念,它贯穿于高中化学的全过程,在化...
一、有关概念 1.物质的量 (1)概念:表示物质所含微粒数目多少的物理量 (2)符号:n...
...
碳原子有多种,好比街上卖的苹果,有山东品牌的,也有陕西品牌的。 12 C是其中最常见(...
纵观2007年高考化学试卷(含理科综合卷),有关阿伏伽德罗常数和阿伏加德罗定律的试题...