
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
例1 向 50 mL 0.018 mol·L-1 的 AgNO3 溶液中加 入 50 mL 0.018 mol·L-1 的盐酸,求混合液中 c (Ag+) 是多 少?已知 Ksp (AgCl)=1.0×10-10
解析:
加入盐酸后溶液的总体积为100 mL, c (Ag+) = c (Cl-)=0.009 mol· L-1, c (Ag+)· c (Cl-)=0.009×0.009=8.1× 10-5 > Ksp,有沉淀生成。Ag + 与Cl-恰好完全反应,混 合液中的Ag+ 来源于AgCl 的饱和溶液:AgCl(s)  Ag+(aq)+Cl-(aq),此时 溶液中的 c (Ag+) 和 c (Cl-)是相 等的。 c (Ag+)= c (Cl-)=
Ag+(aq)+Cl-(aq),此时 溶液中的 c (Ag+) 和 c (Cl-)是相 等的。 c (Ag+)= c (Cl-)=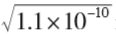 mol·L -1 ≈1.0×10-5 mol·L -1
mol·L -1 ≈1.0×10-5 mol·L -1
例 2 向 50 mL 0.018 mol·L-1 的 AgNO3 溶液中加 入 50 mL 0.02 mol·L-1 的盐酸,生成了沉淀,求沉淀生 成后溶液中 c (Ag+) 是多少?
解析:
此题已告知生成了沉淀,无需沉淀反应的判 断。Ag + 与Cl- 发生沉淀反应后,Cl - 有剩余,因为AgCl 溶解的 Cl- 极少,可忽略。
c (Cl-)≈ ![]() =0.001 mol·L-1
=0.001 mol·L-1
混合液中的 Ag+ 来源于AgCl 的饱和溶液:AgCl(s)  Ag+(aq)+Cl-(aq),剩余的Cl- 会使该平衡向左移动, c(Ag+)减小,此时溶液中的 c (Ag+)和 c (Cl-)是不相等的。
Ag+(aq)+Cl-(aq),剩余的Cl- 会使该平衡向左移动, c(Ag+)减小,此时溶液中的 c (Ag+)和 c (Cl-)是不相等的。
Ksp (AgCl)= c (Ag+)· c (Cl-)/( c )2, c (Ag+)= ![]() mol·L-1 =1.0×10-7 mol·L -1
mol·L-1 =1.0×10-7 mol·L -1
例 3 向 50 mL 0.018 mol·L-1 的 AgNO3 溶液中加 入 50 mL 0.01 mol·L-1 的盐酸,生成了沉淀,求沉淀生成后溶液中c (Ag+) 是多少?
解析:
Ag + 与Cl- 发生沉淀反应后,Ag + 有剩余,因 为AgCl 溶度积很小,AgCl 溶解的 Ag+ 极少, 故混合液 中的Ag+ 主要来源于剩余的Ag+。
c (Ag+)≈ ![]() =0.004 mol·L-1
=0.004 mol·L-1
例 4 已知 298 K 时,MgCO3 的 Ksp =6.82×10-6, 向 0.0002 mol·L-1 的 MgCl2 溶液中加入等体积 0.0002 mol·L -1 Na2CO3 溶液,充分混合后,求混合溶液中 c(Mg2+)。
解 析:
加 入 Na2CO3 溶 液 后, c (Mg2+)= c (CO32-)= 0.0001 mol·L-1。
c (Mg2+)· c (CO32-)=(0.0001)2=1×10-8 < Ksp ,此时Mg 2+和CO32-无沉淀反应,
c (Mg2+)仍为0.0001 mol·L -1。
[ 结论] 两溶液混合后,首先要根据溶度积判断混合过程中是否发生沉淀反应, 若离子积 Q c > Ksp,则沉淀反应发生,参加反应的离子浓度减少,然后要判断反应的离子有否过量,过量的离子会使难溶电解质沉淀溶解平衡逆向移动, 致使难溶电解质溶解度降低。另外计算过程中要注意混合后溶液体积的变化。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。弱酸也可以制备强酸!!! 比如向 CuSO 4 溶液中加入 H 2 S 溶液生成 CuS 黑色沉淀和 ...
氧化还原滴定法: 1.特点: 氧化还原滴定法在药物分析中应用广泛,用于测定具有氧化性...
问题1: 在酸溶液中,H + 和OH - 的来源分别是什么?举例说明怎样计算由水电离产生...
电离平衡常数是高考中一个重要的必考考点,常考查电离平衡常数的计算、弱酸的相对强弱...
...
一、原理:影响水的电离平衡因素 H 2 O H + +OH - 1.25 ℃, → c (H + ) H2O = ...