
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
价键理论简明地阐明了共价键的形成过程和本质,成功解释了共价键的方向性和饱和性,但在解释一些分子的空间结构方面却遇到了困难。例如CH4分子的形成,按照价键理论,C原子只有两个未成对的电子,只能与两个H原子形成两个共价键,而且键角应该大约为90°。但这与实验事实不符,因为C与H可形成CH4分子,其空间构型为正四面体,∠HCH= 109.5°。为了更好地解释多原子分子的实际空间构型和性质,1931年鲍林提出了杂化轨道理论(hybridorbitaltheory),丰富和发展了现代价键理论。1953年,我国化学家唐敖庆等统一处理了s-p-d-f轨道杂化,提出了杂化轨道的一般方法,进一步丰富了杂化理论的内容。
1.杂化轨道理论的基本要点
杂化轨道理论从电子具有波动性、波可以叠加的观点出发,认为一个原子和其他原子形成分子时,中心原子所用的原子轨道(即波函数)不是原来纯粹的S轨道或P轨道,而是若干不同类型、能量相近的原子轨道经叠加混杂、重新分配轨道的能量和调整空间伸展方向,组成了同等数目的能量完全相同的新的原子轨道——杂化轨道(hybridorbital),以满足化学结合的需要。这一过程称为原子轨道的杂化(hybridization)。
下面以CH4分子的形成为例加以说明。
基态C原子的外层电子构型为2s22px12py1。在与H原子结合时,2s上的一个电子被激发到2pz轨道上,C原子以激发态2s12px12py12pz1参与化学结合。当然,电子从2s激发到2p上需要能量,但由于可多生成二个共价键,放出更多的能量而得到补偿。
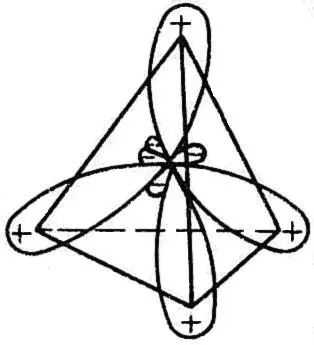
图1.6 sp3杂化轨道示意图
在成键之前,激发态C原子的四个单电子分占的轨道2S、2px、2py、2pz会互相“混杂”,线性组合成四个新的完全等价的杂化轨道。此杂化轨道由一个s轨道和三个p轨道杂化而成,故称为sp3杂化轨道。经杂化后的轨道一头大,一头小,其方向指向正四面体的四个顶角,能量不同于原来的原子轨道(图1.6)。
形成的四个sp3杂化轨道与四个H原子的1s原子轨道重叠,形成(sp3-s)σ键,生成CH4分子。
杂化轨道成键时,同样要满足原子轨道最大重叠原理。由于杂化轨道的电子云分布更为集中,杂化轨道的成键能力比未杂化的各原子轨道的成键能力强,故形成CH4分子后体系能量降低,分子的稳定性增强。
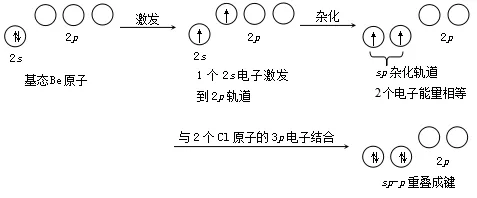
CH4分子形成的整个杂化过程可示意如下:
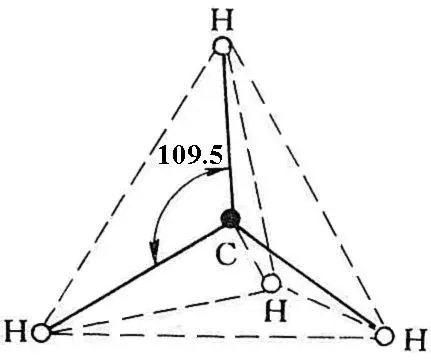
图1.7 CH4分子的空间结构
化合物的空间构型是由满足原子轨道最大重叠的方向所决定的。在CH4分子中,四个sp3杂化轨道指向正四面体的四个顶点,故四个H原子的1S轨道在正四面体的四个顶点方向与四个杂化轨道重叠最大,这决定了CH4的空间构型为正四面体,四个C-H键间的夹角为109.5°(图1.7)。
由以上讨论可归纳得到杂化轨道理论的基本要点为:
⑴同一个原子中能量相近的原子轨道之间可以通过叠加混杂,形成成键能力更强的一组新的原子轨道,即杂化轨道。
⑵原子轨道杂化时,原已成对的电子可以激发到空轨道中而成单个电子,其激发所需的能量可以由成键时放出的能量得到补偿。
⑶n个原子轨道杂化后只能得到n个能量相等、空间取向不同的杂化轨道。
必须注意,孤立原子轨道本身不会杂化形成杂化轨道。只有当原子相互结合形成分子需要满足原子轨道的最大重叠时,才会使原子内原来的轨道发生杂化以获得更强的成键能力。
2.杂化轨道的类型
根据参与杂化的原子轨道的种类和数目的不同,可将杂化轨道分成以下几类。
图1.8 sp杂化轨道示意图
⑴sp杂化
能量相近的一个ns轨道和一个np轨道杂化,可形成二个等价的sp杂化轨道。每个sp杂化轨道含1/2的ns轨道和1/2的np轨道的成份,轨道呈一头大、一头小,两sp杂化轨道之间的夹角为180°(图1.8)。分子呈直线型构型。
例如气态BeCl2分子的形成。基态Be原子的外层电子构型为2s2,无未成对电子,似乎不能再形成共价键,但Be的一个2s电子可以激发进入2p轨道,取sp杂化形成二个等价的sp杂化轨道,分别与Cl的3p轨道沿键轴方向重叠,生成二个(sp-p)σ键。故BeCl2分子呈直线型。
此外CO2分子、[Ag(NH3)2]+离子以及周期表ⅡB族Zn、Cd、Hg元素的某些共价化合物,如ZnCl2、HgCl2等,其中心原子也是采取sp杂化的方式与相邻原子结合的。
⑵sp2杂化
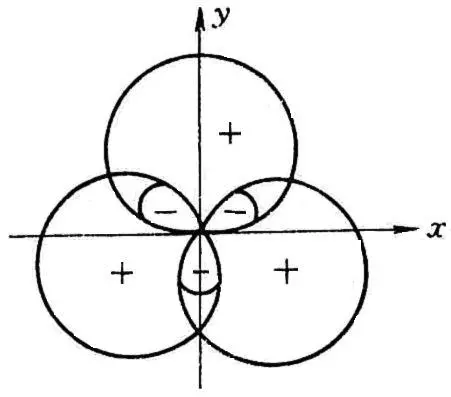
图1.9 sp2杂化轨道示意图
能量相近的一个ns轨道和二个np轨道杂化,可形成三个等价的sp2杂化轨道。每个sp2杂化轨道含有1/3的ns轨道成份和1/3的np轨道成份,轨道呈一头大、一头小,各sp2杂化轨道之间的夹角为120°(图1.9)。分子呈平面三角形构型。
例如,BF3分子的形成。基态B原子的外层电子构型为2s22p1,似乎只能形成一个共价键。按杂化轨道理论,成键时B的一个2s电子被激发到空的2p轨道上,激发态B原子的外层电子构型为2s12px12py1,取sp2杂化,形成三个等价的sp2杂化轨道,指向平面三角形的三个顶点,分别与F的2p轨道重叠,形成三个(sp2-p)σ键,键角为120°。所以,BF3分子呈平面三角形,与实验事实完全相符。
除BF3外,其他气态卤化硼分子,如BCl3,以及NO3-,CO32-等离子的中心原子也是采取sp2杂化成键的。
⑶sp3杂化
能量相近的一个ns轨道和三个np轨道杂化,可形成四个等价的sp3杂化轨道。每个sp3杂化轨道含1/4的ns轨道成份和1/4的np轨道成份,轨道呈一头大、一头小,分别指向正四面体的四个顶点,各sp3杂化轨道间的夹角为109.5°。分子呈四面体构型。
除CH4分子外,CCl4、CHCl3、CF4、SiH4、SiCl4、GeCl4、ClO4-等分子和离子也是采取sp3杂化的方式成键的。
不仅ns、np原子轨道可以杂化,能量相近的(n-1)d、nd原子轨道也可以参与杂化,得到s-p-d型杂化轨道,将在稍后的1.1.3节中继续讨论。
3.等性杂化和不等性杂化
以上讨论的三种S-P杂化方式中,参与杂化的均是含有未成对电子的原子轨道,每一种杂化方式所得的杂化轨道的能量、成份都相同,其成键能力必然相等,这样的杂化轨道称为等性杂化轨道。
但若中心原子有不参与成键的孤对电子占有的原子轨道参与了杂化,便可形成能量不等、成份不完全相同的新的杂化轨道,这类杂化轨道称为不等性杂化轨道。NH3、H2O分子就属于这一类。
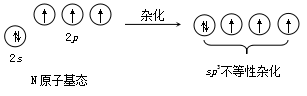
基态N原子的外层电子构型为2s22px12py12pz1,成键时这四个价电子轨道发生了sp3杂化,得到四个sp3杂化轨道,其中有三个sp3杂化轨道分别被未成对电子占有,和三个H原子的1s电子形成三个σ键,第四个sp3杂化轨道则为孤对电子所占有。该孤对电子未与其他原子共用,不参与成键,故较靠近N原子,其电子云较密集于N原子的周围,从而对其他三个被成键电子对占有的sp3杂化轨道产生较大排斥作用,键角从109.5°压缩到107.3°。故NH3分子呈三角锥形(图1.10)。
H2O分子中O原子采取sp3不等性杂化,有二个sp3杂化轨道分别为孤对电子所占有,对其他二个被成键电子对占有的sp3杂化轨道的排斥更大,使键角被压缩到104.5°。故H2O分子的空间构型呈V型(图1.11)。
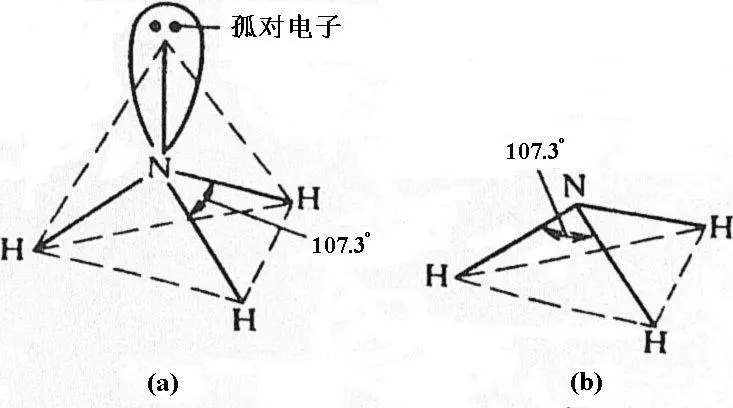
图1.10 NH3分子的空间结构
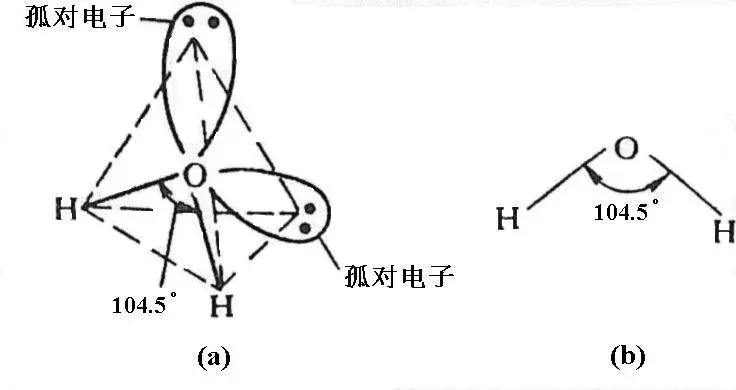
图1.11 H2O分子的空间结构
杂化轨道理论成功地解释了许多分子的键合状况以及分子的形状、键角等等。但是由于过分强调了电子对的定域性,因而对有些实验事实如光谱和磁性(例如氧分子的顺磁性)等无法加以解释。
对杂化轨道理论的认识
(1)杂化:在形成多原子分子的过程中,中心原子的若干能量相近的原子轨道重新组合,形成一组新的轨道,这个过程叫做轨道的杂化,产生的新轨道叫杂化轨道。
(2)杂化过程(以CH4分子的正四面体结构为例分析)
甲烷的分子模型表明其空间构型为正四面体形,分子中的C—H键是等同的,键角是109°28′,但碳原子的价电子构型2s22p2,是由1个2s轨道和3个2p轨道组成的,4个原子轨道应该不同,为了解释这个构型鲍林提出了杂化轨道理论:杂化轨道理论认为形成甲烷分子时,中心C原子的2s和2px,2py,2pz等4条原子轨道发生杂化,形成一组新的杂化轨道,即4条sp3杂化轨道,这些sp3杂化轨道不同于s轨道,也不同于p轨道。但4条sp3杂化轨道的能量、成分完全相同,4条杂化轨道上的电子相互排斥,使4条sp3杂化轨道向空间正四面体的4个顶点伸展,C原子的4条sp3杂化轨道与4个H原子的1S轨道形成4个完全相同的σ键,即4个C-H键完全相同,所以CH4为正四面体结构。
(3)杂化轨道类型
根据参与杂化的S轨道与P轨道的数目,除了有sp3杂化外,还有sp杂化和sp2杂化。
①sp杂化:sp杂化轨道表示由1个s轨道1个p轨道杂化,当中心原子取sp杂化轨道时,杂化后得到2个夹角为180°的直线形杂化轨道。中心原子上有一对垂直于分子骨架的未参与杂化的p轨道。例如CO2中的碳原子、H-C≡N:中的碳原子、BeF2分子中的铍原子等等都是sp杂化。
②sp2杂化:sp2杂化轨道表示由1个S轨道2个p轨道杂化,杂化后得到3个夹角为120°的平面三角形杂化轨道。BCl3、CO32-、NO3-、H2C=O、SO3、烯烃>C=C<结构中的中心原子都是以sp2杂化的,以sp2杂化轨道构建结构骨架的中心原子必有一个垂直于sp2轨道的未参与杂化的P轨道,如果这个轨道跟邻近原子上的平行P轨道重叠,并填入电子,就会形成π键。
③ sp3杂化:sp3杂化轨道表示由1个S轨道3个p轨道杂化,杂化后得到4个夹角为109°28′的正四面体型杂化轨道。sp3杂化过程中所有p电子全部参与杂化,形成4个完全相同的σ键,没有π键。如CH4、CCl4、NH3、H2O等的中心原子采取的就是sp3杂化
④应用:利用杂化轨道理论即可解释分子的空间构型,也可以作为判断分子空间构型的依据,如下表所示:
杂化类型 | sp | sp2 | sp3 |
用于杂化的原子轨道数 | 2 | 3 | 4 |
杂化轨道间的夹角 | 180° | 120° | 109°28′ |
空间构型 | 直线形 | 平面三角形 | 四面体形 |
⑤杂化轨道的特点:
A.形成分子时,通常存在激发、杂化和轨道重叠等过程。
B.原子轨道的杂化只有在形成分子的过程中才会发生,孤立的原子是不可能发生杂化的。
C.杂化轨道的数目杂化前后轨道数目不变。
D.杂化后轨道伸展方向,形状发生改变。
E.只有能量相近的轨道才能杂化(2s和2p)。
F.杂化轨道成键时要满足化学键间最小排斥原理,可由杂化轨道间的夹角→分子空间构型。
G.杂化轨道的角度部分一头大,一头小,成键时利用大的一头,可以使轨道重叠程度更大,从而形成稳定的化学键。即杂化轨道增强了成键能力。
H.杂化轨道所形成的化学键全部为σ键。
注意:杂化只发生在s轨道和p轨道之间,即杂化轨道只可用于形成σ键或者来容纳未参与成键的孤对电子。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。1mol 氨中氢键数量分析 一、氢键形成机制 NH分子结构 H原子作为氢键供体(需与高电负性...
二氧化氮(NO)中氮原子的杂化类型为 sp杂化,具体分析如下: 1.计算 n (的价层电子对数...
...
【导读】 以下是快速判定氢键强弱的基本原则,实际案例中经常会进一步考虑综合因素的...
根据价电子互斥理论, ClO 2 中氯原子周围的价电子对数计算为 3.5,理论上应倾向于 sp...
【导读】分子间作用力(范德华力)的来源是取向力、诱导力和色散力。 ①一般情况下,极...