
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
在“难点四:突破电子式书写的困惑”中,已经详细介绍了利用路易斯理论写电子式的方法。但对于有些物质来说,利用这种方法,并不能写出电子式。
在学习配位键后,将其与路易斯理论结合,就能写出更多的物质的路易斯理论的电子式。
一、用路易斯理论和配位键理论分析一些分子的结构,写电子式和结构式。
例如SO3,S有6个价电子,与其中一个2对共用电子对,用掉2个电子。又形成了两个配位键,用掉4个电子。剩余电子数为0。
其结构式为:
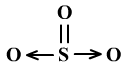
电子式为:
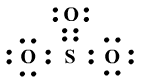
用配位键和路易斯理论可以写出满足SO3每个原子的八电子稳定结构的电子式和结构式。
下列分子或离子都可以用配位键写成八电子稳定结构:
CO、NO3-、SO42-、SO32-、ClO3-、PO43-
二、VSEPR模型、分子或离子的立体构型、中心原子的杂化类型
要学会推理VSEPR模型,需要先会用路易斯理论推理电子式。
推理出VSEPR模型后,就可以推理出分子或离子的立体构型和中心原子的杂化类型。
1、推理VSEPR模型的具体方法是:
(1)推理出电子式。
(2)找出σ键数和孤电子对数。
(3)计算:价层电子对数=σ键数+孤电子对数
(4)下面表格为价层电子对数对应的模型名称:
| 价层电子对数 | VSEPR模型名称 |
2 | 直线 |
3 | 平面三角形 |
4 | 四面体形 |
5 | 六面体形 |
6 | 八面体形 |
例如SO3,
(1)推理出电子式。

若不会推理带配位键的电子式,用周围原子的八电子稳定结构,中心原子不考虑八电子稳定结构,进行推理也可以。
如将SO3推理为:
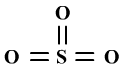
(2)找出σ键数和孤电子对数。
σ键数为3,孤电子对数为0。
(3)计算价层电子对数。价层电子对数=σ键数+孤电子对数=3+0=3。
(4)VSEPR模型名称为平面正三角形。
练习:SO42-、SO2、PCl5、SF6、BF3、SO32-、NO3-、NO2-、CO2、CO32-、PO43-、ClO2-、ClO3、ClO4-
2、推理分子或离子的立体构型
推理出VSEPR模型后:
若无孤电子对,则VSEPR模型名称和分子或离子的立体构型名称相同。
例如,SO3的VSePr模型名称为平面正三角形。SO3无孤电子对,它的分子的立体构型名称为平面正三角形。
若有孤电子对,则VSEPR模型去掉孤电子对的构型,才是分子或离子的立体构型。
例如,NH3的VSEPR模型名称为四面体形。NH3有一对孤电子对,去掉孤电子对后,它的分子的立体构型名称为正三角锥形。
3、推理中心原子的杂化类型:
推理出VSEPR模型的价层电子对数,就可以知道中心原子的杂化类型。
| 价层电子对数 | 杂化类型 |
2 | sp |
3 | sp2 |
4 | sp3 |
5 | sp3d(非金属或金属) dsp3(金属) |
6 | sp3d2(非金属或金属) d2sp3(金属) |
例如SO3的价层电子对数为3,杂化类型为sp2杂化。
SF6的价层电子对数为6,杂化类型为sp3d2杂化。
PtCl4(NH3)2的配位数为6,杂化类型为d2sp3杂化。
【练习】
分别写出ClO2-、PO43-带配位键的结构式、电子式、VSePr模型名称、离子的立体构型名称、中心原子的杂化类型。
【练习答案】
ClO2-:
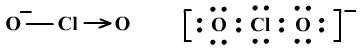 、四面体形、V形、sp3杂化。
、四面体形、V形、sp3杂化。
PO43-:
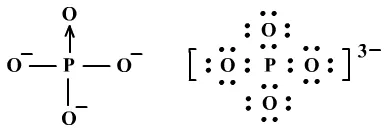 、正四面体形、正四面体形、sp3杂化。
、正四面体形、正四面体形、sp3杂化。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。陷阱1、物质的状态。 命题中常涉及物质的体积,需考虑是否为气体。 例如,标准状况下H...
一、数列的表达式问题 例:(2019高考全国卷Ⅲ)直链的多磷酸盐是一种复杂磷酸盐,如:...
晶体中某原子或离子的配位数:是指离中心原子或离子最近的原子或离子的个数。 1 、观...
在“难点四:突破电子式书写的困惑”中,已经详细介绍了利用路易斯理论写电子式的方法...
1 、熟悉常见的有机合成路线 RCH=CH 2 → RCH 2 CH 2 X → RCH 2 CH 2 OH → RCH 2 CH...
现在很多简单的实验考查,常常不再考查明显的实验错误,而是考查实验的细节问题。 一...