
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
一、理解核外电子运动状态的决定因素
1、一个核外电子的运动状态由因素决定:能层、能级、轨道、自旋方向。
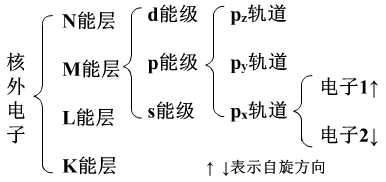
2、各因素的意义:
(1)不同能层上的电子的能量不同,不同能级上的电子能量也不相同。同一能级上的电子,同一轨道上的电子的能量都是相同的。电子首先充满低能量轨道。同一能级上的电子根据需要可以在不同轨道上重排。
(2)轨道是指的电子的空间运动状态,也就是电子所处的空间,它决定了键的方向和分子的构型。
(3)原子中的电子跃迁与电子所在的能级变化有关,能产生可见光等能量释放或吸收。
(4)电子的填充顺序并不只是按能层填充,而是按构造原理和能量最低原理依次填充。
(5)分析价电子时,也是按能级的填充情况来分析,不是按能层来分析。
(6)分析轨道杂化、离域π键、配位键时,主要分析的是轨道填充情况。
(7)泡利原理决定了共用电子对的形成。
(8)洪特规则也许与杂化有关。
二、注意构造原理与能量最低原理的区别。
构造原理与能量最低原理很相近,在很多地方也是一致的。
但对于第四周期的Cr和Cu,它们的电子排布不完全符合构造原理。它们的电子排布为[Ar]3d54s1和[Ar] 3d104s1,而不是为[Ar]3d44s2和[Ar] 3d94s2。但这种电子排布一定是符合能量最低原理的。(半充满或全充满能量更低)
所以有个别原子的核外电子排布若不符合构造原理,那一定符合能量最低原理。
三、注意电子的空间运动状态与电子的运动状态之间的区别
电子的空间运动状态,是指电子所在的轨道,也就是能级中的2px或3dxy等轨道。
电子的运动状态,除了指电子所在的轨道外,还包括电子的自旋方向。例如某电子的运动状态是在4Pz轨道中进行正向自旋。
原子核外的每个电子的运动状态是唯一的。电子的空间运动状态,最多有两个是相同的。
四、构造原理、能量最低原理、泡利原理、洪特规则之间的关系。
构造原理是能量最低原理、泡利原理、洪特规则的外在表现。
半充满、全充满、全空更稳定,是洪特规则的特例。
能量最低原理、泡利原理、洪特规则,决定了原子的核外电子排布方式,也决定了化学性质。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。陷阱1、物质的状态。 命题中常涉及物质的体积,需考虑是否为气体。 例如,标准状况下H...
一、数列的表达式问题 例:(2019高考全国卷Ⅲ)直链的多磷酸盐是一种复杂磷酸盐,如:...
晶体中某原子或离子的配位数:是指离中心原子或离子最近的原子或离子的个数。 1 、观...
在“难点四:突破电子式书写的困惑”中,已经详细介绍了利用路易斯理论写电子式的方法...
1 、熟悉常见的有机合成路线 RCH=CH 2 → RCH 2 CH 2 X → RCH 2 CH 2 OH → RCH 2 CH...
现在很多简单的实验考查,常常不再考查明显的实验错误,而是考查实验的细节问题。 一...