
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
HMO法认为形成离域大π键的条件为:
(l)形成离域大π键的原子均在同一平面上;
(2)p电子数必须小于p轨道数的两倍。怎
样正确写出某个离域大π键的πmn表达式呢?下面谈谈自己的一点休会。
步骤:
(l)判断该分子有无形成大π键的可能,并确定n值;
(2)将有关原子间以短线相连;
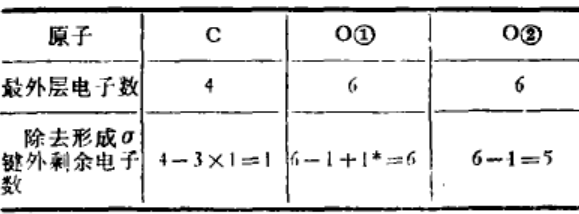
(3)计算最外层电子数及剩余电子数(同时考虑电荷);
(4)检查有无未配对电子,并计算m值。
例如:CO32-
(l)判断可能性:根据价电子对互斥理论,碳原子周围有3对价电子,即CO32-是平面三角形结构,碳原子的三个sp2杂化轨道分别与三个氧原子形成三个σ键,还剩下一个p轨道,三个氧原子均有一个与之平行的p轨道,即CO32-有形成离域大π键的可能,且n=4
(2)短线连结有关原子:
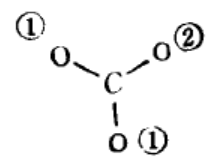
(3)计算电子数并排布电子
排布:
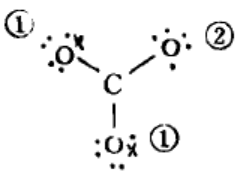
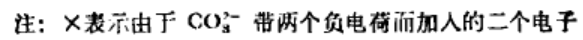
(4)检查有无未配对电子:

l×l+2×2+l×1=6
即CO32-中离域大π键的表达式为π64
说明:(l)由于杂化的原因,在书写过程中必须同时考虑s、p轨道;
(2)若是离子,则应在体系中某几个原子上增减与电荷数相等的电子数(正减负加;)
(3)对于无未配对电子的原子,若除形成以短线表示的σ键外有剩余电子,应有2个电子参与离域大π键的形成;若有单个电子则此电子参与成键;
(4)用此法书写π表达式不必考虑配位键的单向供电子性,因为这对整个分子体系的电子数无影响.
如CO(CN)42-用两种方法计算均得π89同一结果;
考虑配位键:
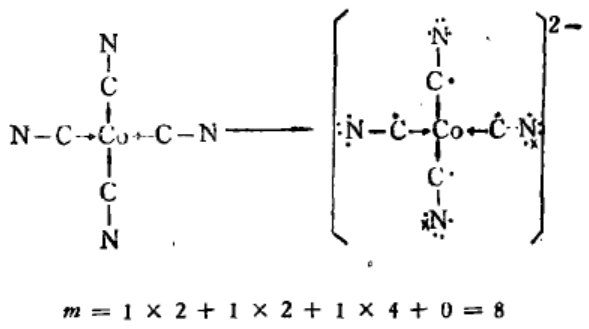
不考虑配位键:




 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。分析: 依据价层电子对数计算公式分析, 可得价层电子对数=5=[2+3],故有2个配位原子...
...
比较键角大小分析思路: 参照以下顺序来判断键角大小 ①先从中心原子的杂化类型来入手...
顺反异构中,分子的对称性、极性以及熔点和沸点存在以下差异: 1.对称性比较 反式异构...
01 — 概念 在多原子分子(就是三个或三个以上的原子构成的分子)中,如有相互平行的p...
含有共价键的物质中相邻两键之间的夹角称为键角。键角是决定物质分子空间构型的主要因...