
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
蒸发盐溶液时最终能否得到溶质,与溶质的稳定性、水解性、还原性有关:
1.判断盐的稳定性。判断该盐是否稳定。有些盐不稳定,加热蒸干后会发生分解,检查盐加热后是否会分解如: Ca(HCO3)2由于不稳定加热蒸干后,分解为 CO2和水蒸气( H2O ) 挥发后剩下的物质是 CaCO3::
![]()
2.判断盐的还原性。判断该盐是否还原性物质,是否发生氧化还原反应。有些还原性物质加热时在空气中氧气的作用下会被氧化。如 Na2SO3加热时被空气中 O2氧化为 Na2SO4:
![]()
3.判断盐水解后是否生成挥发性酸。判断该盐水解后是否生成挥发性酸,一般强酸弱碱盐或强碱弱酸盐会发生水解,如 AlCl3是强酸弱碱盐 , 水解后生成 Al(OH)3, 和 HCl ,由于 HCl 是挥发性酸, AlCl3溶液蒸干后余下的物质为 Al(OH)3,如果继续灼烧,则产物为 Al2O3。可用下图分析微观过程::
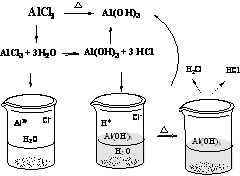
4.判断盐是否为多元弱酸强碱盐。多元弱酸强碱盐一般有 Na2PO4、 Na2CO3、 Na2SiO3、 Na2S 等。这些盐水解的产物会重新反应生成原物质,最后得到原溶质。如蒸干 Na2CO3盐溶液得到的物质仍然是 Na2CO3,微观过程::
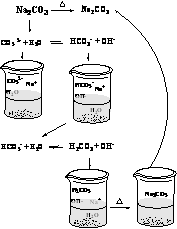
5.综合分析判断同时存在水解性、不稳定性的盐。由于 NaClO 是弱酸强碱盐,ClO-发生水解后产生的弱酸 HClO 不稳定会分解成 HCl 和 O2, HCl 与水解产生的 NaOH 发生反应得到 NaCl ,因此加热蒸发 NaClO 溶液最后得到的是 NaCl 固体。微观过程:
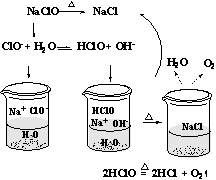
6.综合分析判断同时存在水解性、不稳定性、还原性的盐。蒸发时要综合考虑水解性、不稳定性、还原性的盐。如加热蒸发 FeCl2溶液时, Fe2+被空气中的 O2氧化为 Fe3+, Fe3+水解成 Fe(OH)3, 同时产生挥发性酸 HCl, 蒸干 FeCl2溶液时 剩下的物质是 Fe(OH)3, 如果再继续灼烧得到的产物为 Fe2O3。是否不水解、稳定的、非还原性的盐蒸发不水解、不分解、不氧化的盐,得到的物质为该盐的晶体。如 NaCl, Na2SO4
科学的思想方法:判断盐溶液蒸干后所得物质,要综合考虑多种因素,比如该盐的稳定性、是否发生水解、还原性等,另外还有考虑在这个体系中盐的稳定性、该盐溶液的酸碱性,即是强酸弱碱盐(酸性)、弱酸强碱盐(碱性)、还是中性(强酸强碱盐)、还原性有一个因素还是同时存在几种因素?要综合考虑、逐步分析,以动态方式(涉及到分解反应、水解反应、氧化还原反应)思考问题。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。酸碱滴定法 强酸滴定强碱的反应 强酸滴定弱碱的反应 混合碱的滴定(双指示剂法+滴定突...
【学生疑问】 教材上有两个实验,一个是 AgI 转化为 Ag 2 S,一个是 Mg(OH) 2 转化为 ...
25 ℃ 时, K a1 (H 2 S)=1.1 × 10 -7 ; K a2 (H 2 S)=1.3 × 10 -13 . (高等教育...
沉淀转化是沉淀溶解平衡的应用之一。 对于溶度积较大的沉淀转为溶度积较小的沉淀这类...
1.实例 常温下,用0.100 0 mol·L -1 NaOH溶液滴定20.00 mL 0.100 0 mol·L -1 CH 3...
问题呈现:pH=5的稀盐酸加水冲稀1000倍,稀释后溶液的pH=?请通过计算说明。 错解:由...