
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
一、基本原理:
FeCl3属于强酸弱碱盐,溶于水后Fe3+发生水解,使溶液显酸性。
FeCl3+3H2O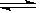 Fe(OH)3+3HCl,离子方程式为Fe3++3H2O
Fe(OH)3+3HCl,离子方程式为Fe3++3H2O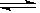 Fe(OH)3+3H+。实验测得,FeCl3的水解程度较大,在加热或稀释条件下,水解平衡正向移动,如果加入电解质会影响到溶液中H+浓度,也会影响FeCl3的水解程度。FeCl3溶液的水解以及水解平衡的移动在实际中有很多应用,是高考的热点之一。
Fe(OH)3+3H+。实验测得,FeCl3的水解程度较大,在加热或稀释条件下,水解平衡正向移动,如果加入电解质会影响到溶液中H+浓度,也会影响FeCl3的水解程度。FeCl3溶液的水解以及水解平衡的移动在实际中有很多应用,是高考的热点之一。
二、应用典例
(一)抑制FeCl3水解
1、实验室如何配制FeCl3溶液?
为了抑制FeCl3水解,将FeCl3固体溶于较浓的盐酸中,然后用蒸馏水稀释至所需要的浓度。
2、加热FeCl3溶液能得到无水FeCl3固体吗?如何得到无水FeCl3固体?
FeCl3溶液中存在FeCl3的水解平衡,加热促进其水解,又由于生成的氯化氢气体不断挥发,使水解趋于完全,生成的Fe(OH)3在灼烧时发生分解反应2Fe(OH)3 Fe2O3十3H2O,最终得到的是Fe2O3,而得不到无水FeCl3固体。
Fe2O3十3H2O,最终得到的是Fe2O3,而得不到无水FeCl3固体。
要想得到无水FeCl3固体,需要抑制FeCl3水解,可以将FeCl3溶液在HCl气流中蒸干。
(二)促进FeCl3水解
3、如何配制Fe(OH)3胶体?
将12 mL饱和FeCl3溶液滴入20 mL沸水中,继续加热至红褐色为止。化学方程式:
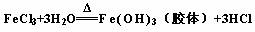
4、如何除去MgCl2溶液中少量的FeCl3?
可以利用FeCl3的水解反应,向溶液中加入氧化镁、碳酸镁等,消耗FeCl3水解产生的HCl,促进FeCl3水解,生成MgCl2,这样既不引入新的杂质,又能将FeCl3转化为Fe(OH)3沉淀除去。
5、实验中手不慎被玻璃划破,FeCl3溶液为何能够应急止血?
血液是一种胶体,其中的血液胶体微粒带负电荷,遇到FeCl3溶液(溶液中含有带正电荷的Fe(OH)3胶粒)将其电荷中和掉,使血液胶体发生聚沉,从而起到止血的作用。
三、链接高考
铁及铁的化合物应用广泛,如FeCl3可用作催化剂、印刷电路铜板腐蚀剂和外伤止血剂等。
(1)写出FeCl3溶液腐蚀印刷电路铜板的离子方程式__________。
(2)若将(1)中的反应设计成原电池,请画出原电池的装置图,标出正、负极,并写出电极反应式。正极反应______,负极反应___________。
(3)腐蚀铜板后的混合溶液中,若Cu2+、Fe3+和Fe2+的浓度均为0.10 mol·L-1,请参照下表给出的数据和药品,简述除去CuCl2溶液中Fe3+和Fe2+的实验步骤:
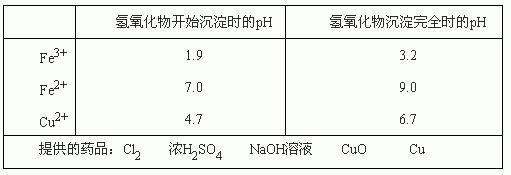

提供的药品:Cl2 浓H2SO4 NaOH溶液 CuO Cu
(4)某科研人员发现劣质不锈钢在酸中腐蚀缓慢,但在某些盐溶液中腐蚀现象明显。请从上表提供的药品中选择两种(水可任选),设计最佳实验,验证劣质不锈钢易被腐蚀。有关反应的化学方程式 、 劣质不锈钢腐蚀的实验现象: 。
解析:本题第三问涉及应用FeCl3水解的知识除杂的问题,欲一起除去CuCl2溶液中Fe3+和Fe2+,应该首先将Fe2+氧化为Fe3+,然后加入氧化铜调节溶液的pH,氧化铜与Fe3+水解生成的H+反应,促进Fe3+水解平衡正向移动生成Fe(OH)3沉淀而除去。
参考答案:
(1)2Fe3++Cu=2Fe2++Cu2+
(2)装置图:(见图)正极反应:2Fe3++2e-=2Fe2+ 负极反应:Cu-2e-=Cu2+
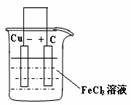
(3)①通入足量氯气将Fe2+氧化成Fe3+;②加入CuO调节 溶液的pH至3.2~4.7;③过滤[除去Fe(OH)3]
(4)CuO+H2SO4=CuSO4+H2O CuSO4+Fe=FeSO4+Cu, 不锈钢表面有紫红色物质生成。
四、跟踪练习:
1、在水中滴入少量的FeCl3饱和溶液,为促铁离子的水解,不应采取的措施是( )。
A.增加铁离子的浓度 B.升温 C.稀释 D.加入碳酸镁
2、将饱和FeCl3溶液分别滴入下述液体中,能形成胶体的是( )。
. A、冷水 B、沸水 C、NaOH浓溶液 D、NaCl浓溶液
参考答案:
1、A 2、B(提示:FeCl3在冷水中水解程度小,形不成胶体;在NaOH溶液中生成Fe(OH)3沉淀;胶体遇电解质易形成沉淀,故在NaCl浓溶液中也不会形成胶体。)
FeCl3是我们接触到的一种重要试剂,关于它的水解也有多种考查方式,只要我们抓住它水解的实质以及影响水解的外在因素,无论从什么角度考查,我们都能对答如流。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。酸碱滴定法 强酸滴定强碱的反应 强酸滴定弱碱的反应 混合碱的滴定(双指示剂法+滴定突...
【学生疑问】 教材上有两个实验,一个是 AgI 转化为 Ag 2 S,一个是 Mg(OH) 2 转化为 ...
25 ℃ 时, K a1 (H 2 S)=1.1 × 10 -7 ; K a2 (H 2 S)=1.3 × 10 -13 . (高等教育...
沉淀转化是沉淀溶解平衡的应用之一。 对于溶度积较大的沉淀转为溶度积较小的沉淀这类...
1.实例 常温下,用0.100 0 mol·L -1 NaOH溶液滴定20.00 mL 0.100 0 mol·L -1 CH 3...
问题呈现:pH=5的稀盐酸加水冲稀1000倍,稀释后溶液的pH=?请通过计算说明。 错解:由...