
|
学习小专题 |

|
学习小专题 |
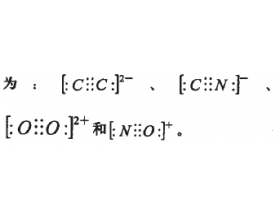 [注解与辨疑e] 浅议等电子原理 作者:邱东兰 来源:未知 日期:2022-11-21 08:48:19 点击:1077 所属专题:等电子体
[注解与辨疑e] 浅议等电子原理 作者:邱东兰 来源:未知 日期:2022-11-21 08:48:19 点击:1077 所属专题:等电子体
等电子原理是现行普通高中课程标准 实验教科书化学选修3《物质结构与性质》 第二章《分子结构与性质》的第一节《共价键》中的一个重要的知识内容。 其概念是这样定义的原子总数相同且 价电子总数也相同的分子或离子具有相同 的结构特征,这个原理就称为“等电子原 理”...
 [注解与辨疑e] 常见的等电子体及其空间结构 作者:鲁志超 来源:未知 日期:2022-11-21 08:41:18 点击:1483 所属专题:等电子体
[注解与辨疑e] 常见的等电子体及其空间结构 作者:鲁志超 来源:未知 日期:2022-11-21 08:41:18 点击:1483 所属专题:等电子体
...
 [注解与辨疑e] 浅析中学十种物质成键情况 作者:罗成 来源:未知 日期:2016-05-09 15:13:36 点击:1296 所属专题:σ键 π键 结构式
[注解与辨疑e] 浅析中学十种物质成键情况 作者:罗成 来源:未知 日期:2016-05-09 15:13:36 点击:1296 所属专题:σ键 π键 结构式
...
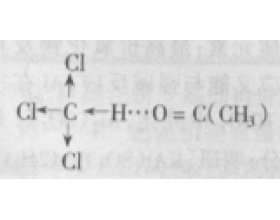 [注解与辨疑e] 氢键知识问答 作者:朱照鹰 来源:未知 日期:2016-04-24 18:02:07 点击:4746 所属专题:氢键02
[注解与辨疑e] 氢键知识问答 作者:朱照鹰 来源:未知 日期:2016-04-24 18:02:07 点击:4746 所属专题:氢键02
氢键是新教材补充的知识点,初学者对氢键 的认识较模糊,现就如何理解有关氢键的几个问题做如下提示。 1.氢键是否只能在H和N、O、F之间形成? 答:不一定。氢键通常用X-H ··· Y表示,其中X、Y代表N、O、F等电负性强、具有弧对电子、原子半径小的非金属原子。除了常规氢...
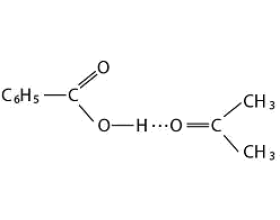 [探讨与扩展a] 氢键概述 作者:马文礼 来源:未知 日期:2016-04-19 10:58:03 点击:3887 所属专题:氢键02
[探讨与扩展a] 氢键概述 作者:马文礼 来源:未知 日期:2016-04-19 10:58:03 点击:3887 所属专题:氢键02
一、氢键的本质 氢原子似乎可以同时和两个电负性很大而原子半径较小的原子(如O、F、N等)相结合,一般表示为X—H…Y,其中H…Y的结合力就是氢键。 关于氢键的本质,直到目前为止还没有圆满的解决。一般认为X—H…Y里,X—H键基本是共价键,而H…Y则是一种强有力的有方向...
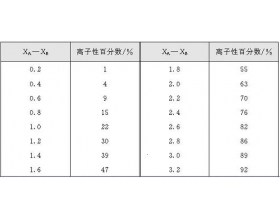 [注解与辨疑e] 键的极性与键的种类判断 作者:代鹏 来源:未知 日期:2016-04-19 09:41:27 点击:6413 所属专题:键的极性 共价键 离子键
[注解与辨疑e] 键的极性与键的种类判断 作者:代鹏 来源:未知 日期:2016-04-19 09:41:27 点击:6413 所属专题:键的极性 共价键 离子键
在共价化合物中,由于不同元素的原子吸引电子的能力不同,共用电子对就必然或多或少地偏向于对它吸引力较大的那个原子(即电子云密度大的地方将偏近于这个原子),所以形成的键就具有不同程度的极性。两种元素的电负性相差越大,它们之间键的极性就越强,其中,电负性较大的原...
 [注解与辨疑e] 共价键概述 作者:段文娟 来源:未知 日期:2016-04-19 09:32:43 点击:1243 所属专题:共价键
[注解与辨疑e] 共价键概述 作者:段文娟 来源:未知 日期:2016-04-19 09:32:43 点击:1243 所属专题:共价键
键参数和分子的性质之间有一定的相关性。从键参数的数据可以归纳出某些定性的或半定量的规律用以说明分子的某些性质。所谓键参数指的是用于表征化学键性质的物理量,如键能、键长、键角等物理量的数据。 (1)键能 在101 kPa和25 ℃下,将1 mol理想气体分子AB拆开为中性气态...
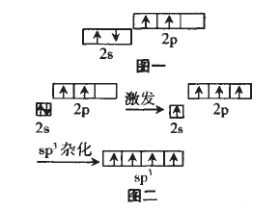 [注解与辨疑e] 浅析杂化轨道理论与价电子对互斥理论的理解与应用 作者:郝凯军 来源:江苏沛县中学 日期:2016-04-01 11:43:39 点击:3274 所属专题:杂化轨道理论 价电子对互斥理论
[注解与辨疑e] 浅析杂化轨道理论与价电子对互斥理论的理解与应用 作者:郝凯军 来源:江苏沛县中学 日期:2016-04-01 11:43:39 点击:3274 所属专题:杂化轨道理论 价电子对互斥理论
杂化轨道理论与价电子对互斥理论是 高中选修化学《物质结构与性质》中的重点 与难点,并且这部分教材对很多教师来说 还是崭新的内容,笔者对于这部分内容有 一些体会,想与大家分享。 一、轨道进行杂化的原因 原子为了更好的成键。这里的“更好” 包括“更多”和“更强...
 [注解与辨疑e] 杂化轨道理论在高中化学中的应用 作者:黄晓东 来源:甘肃武威三中 日期:2016-03-19 22:15:05 点击:1065 所属专题:杂化轨道理论
[注解与辨疑e] 杂化轨道理论在高中化学中的应用 作者:黄晓东 来源:甘肃武威三中 日期:2016-03-19 22:15:05 点击:1065 所属专题:杂化轨道理论
...
 [注解与辨疑e] 氢键释疑 作者:栾凯 来源:未知 日期:2016-03-17 10:36:44 点击:4087 所属专题:氢键02
[注解与辨疑e] 氢键释疑 作者:栾凯 来源:未知 日期:2016-03-17 10:36:44 点击:4087 所属专题:氢键02
问题1:氢键是如何形成的? 答:形成氢键是H特有的性质,半径很小的 H与电负性大的X形成共价键后,由于X吸引价 电子能力大,使H几乎成为“裸露”的质子,由于质子的半径特别小(30pm),可以与另一个具有孤对电子的电负性大的Y相互作用形成Z—H Y 氢键。 问题2:决定氢键强弱的因...
 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。通常而言,同主族元素形成的X-X键,自上而下,键长逐渐增大,键能逐渐降低。 根据元素...
无机化学实验是一门与无机化学理论课密切配合的课程。实验用化学事实充实了理论课的学...
能否形成氢键的“视点”:一看有无电负性...
1mol 氨中氢键数量分析 一、氢键形成机制 NH分子结构 H原子作为氢键供体(需与高电负性...
二氧化氮(NO)中氮原子的杂化类型为 sp杂化,具体分析如下: 1.计算 n (的价层电子对数...
...
【导读】 以下是快速判定氢键强弱的基本原则,实际案例中经常会进一步考虑综合因素的...
根据价电子互斥理论, ClO 2 中氯原子周围的价电子对数计算为 3.5,理论上应倾向于 sp...