
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
键参数和分子的性质之间有一定的相关性。从键参数的数据可以归纳出某些定性的或半定量的规律用以说明分子的某些性质。所谓键参数指的是用于表征化学键性质的物理量,如键能、键长、键角等物理量的数据。
(1)键能
在101 kPa和25 ℃下,将1 mol理想气体分子AB拆开为中性气态原子A和B时,所需的能量叫做AB的离解能(单位为kJ/mol),以D(A—B)表示。例如,H2的离解能D(H—H)为436 kJ/mol。对双原子分子而言,离解能就是键能E,即E(H—H)=D(H—H)=436 kJ/mol,它是指破裂6.02×1023个键(单键)所需要的能量。键能是决定物质性质的一个重要因素。通常键能愈大,表明该化学键愈牢固,由该键组成的分子也就愈稳定。例如,HCl的键能E(H—Cl)=431.8 kJ/mol,HI的键能E(H—I)=298.7 kJ/mol,HCl比HI稳定,HI受热时就较易分解。
通常键能的数据是用热化学方法由实验测定的。
(2)键长
分子中两个原子核间的平均距离叫做键长(或核间距)。理论上用量子力学的近似方法可以算出键长。实际上通常是用光谱或衍射等实验方法来测定键长。
一般来说,两原子之间所形成的键愈短,键能就愈大,键愈强,愈牢固。综上所述,可以用键能和键长二个键参数定量地描述化学键的特征。
(3)键角
键角系指分子中键与键之间的夹角。键角是表示分子空间结构的一个重要参数。例如,H2S分子中2个S—H键之间的夹角是92°,这表明H2S分子是V形结构。
一般来说,如果已知某分子中的键长和键角的数据,就可确定该分子的几何构型(分子在空间呈现的几何形状)。例如,已知CO2分子的C=O键长是0.116 nm,O—C—O键角等于180°,就可得知CO2分子是直线形的非极性分子,据此也可推断它的物理性质。又如,已知NH3分子里的H—N—H键角是107°18′,N—H键长是0.102 nm,就可推断NH3分子是三角锥形的极性分子。

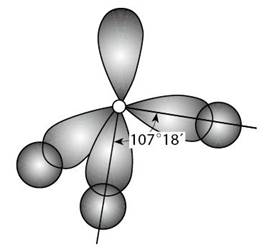
图2-1氨分子结构示意图
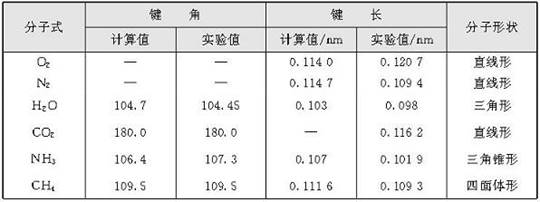
理论上可用量子力学近似方法算出键角,但对于复杂分子来说,实际上是通过光谱、衍射等结构分析实验测定而算出。表2-1是某些分子的键长和键角的数据。
表2-1某些分子的键长和键角数据

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。1mol 氨中氢键数量分析 一、氢键形成机制 NH分子结构 H原子作为氢键供体(需与高电负性...
二氧化氮(NO)中氮原子的杂化类型为 sp杂化,具体分析如下: 1.计算 n (的价层电子对数...
...
【导读】 以下是快速判定氢键强弱的基本原则,实际案例中经常会进一步考虑综合因素的...
根据价电子互斥理论, ClO 2 中氯原子周围的价电子对数计算为 3.5,理论上应倾向于 sp...
【导读】分子间作用力(范德华力)的来源是取向力、诱导力和色散力。 ①一般情况下,极...