
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
一、氢键的本质
氢原子似乎可以同时和两个电负性很大而原子半径较小的原子(如O、F、N等)相结合,一般表示为X—H…Y,其中H…Y的结合力就是氢键。
关于氢键的本质,直到目前为止还没有圆满的解决。一般认为X—H…Y里,X—H键基本是共价键,而H…Y则是一种强有力的有方向性的范德华力。把氢键归入范德华力是因为它在本质上是带有部分负电荷的原子Y与极性很强的极性键X—H之间的静电吸引作用。因为X—H的极性很强,H的半径很小,且又无内层电子,所以允许带有部分负电荷的Y原子无空间阻碍地来充分接近它,产生静电吸引作用而构成氢键。这种吸引作用的能量,一般在41.84 kJ/mol以下,比化学键的键能要小得多,但和范德华力的数量级相同,所以有人把氢键归入范德华力。
但是氢键有两个与一般的范德华力不同的特点,即它的饱和性和方向性。其饱和性表现在X—H只能再和一个Y原子相结合,即一个氢原子不可能同时形成两个氢键。如果另有一个Y原子来接近它们,则将受X和Y的排斥力要比受到H的吸引力来得大,所以X—H不能和两个Y原子相结合。
由于X—H与Y的相互作用,只有当X—H…Y在同一直线上的时候最强烈,所以,在可能范围内要尽量使X—H…Y在同一直线上,这是氢键具有方向性的原因。另一方面Y一般含有孤对电子,在可能范围内,氢键的方向要和孤对电子的对称轴相一致。这样可使Y原子中负电荷分布得最多的部分最接近于H。
二、分子间氢键与分子内氢键
氢键可分为分子间氢键与分子内氢键两大类。一个分子的X—H键与另一个分子的Y相结合而成的氢键,称为分子间氢键。例如,水、甲酸、乙酸等缔合体就是通过分子间氢键而形成的。除了这种同类分子间的氢键外,不同分子间也可形成氢键,例如:
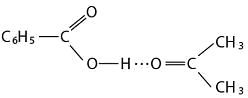
根据红外光谱的研究结果,表明分子间氢键一般是成直线型(其理由见资料9中氢键的方向性的论述)。由于这样,水结成冰其晶体为四面体构型。即每一个水分子,位于四面体中心,在它周围有四个水分子,分别以氢键和它相连。
在某些分子里,如邻位硝基苯酚中的羟基O—H也可与硝基的氧原子生成氢键,即:

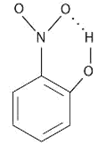
这种一个分子的X—H键与它内部的Y相结合而成的氢键称为分子内氢键。
红外吸收光谱表明,由于受环状结构中其他原子的键角限制,分子内氢键X—H…Y不能在同一直线上(一般键角约为150°左右)。分子内氢键的形成会使分子钳环化。
三、 氢键的形成对化合物性质的影响
分子缔合作用,是由于分子间氢键的形成,钳环化则是由于分子内氢键的形成。两者对于化合物的性质的影响是显著的,并且往往是相反的,现简述如下。
(1)对沸点和熔点的影响
分子间氢键的形成使物质的沸点和熔点升高,因为要使液体气化,必须破坏大部分分子间的氢键,这需要较多的能量;要使晶体熔化,也要破坏一部分分子间的氢键。所以,形成分子间氢键的化合物的沸点和熔点都比没有氢键的同类化合物为高。
分子内氢键的生成使物质的沸点和熔点降低,如邻位硝基苯酚的熔点为45 ℃,而间位和对位硝基苯酚的熔点分别是96 ℃和114 ℃。这是由于间位和对位硝基苯酚中存在着分子间氢键,熔化时必须破坏其中的一部分氢键,所以它们熔点较高;但邻位硝基苯酚中已经构成分子内氢键,不能再构成分子间氢键了,所以熔点较低。
(2)对溶解度的影响
在极性溶剂里,如果溶质分子与溶剂分子间可以生成氢键,则溶质的溶解度增大。如果溶质分子钳环化,则在极性溶剂里的溶解度减小。例如,对硝基苯酚中O—H基,能同水的氧原子缔合成氢键,促使它在水中溶解,因此溶解度大,在水蒸气里不挥发。但邻硝基苯酚的O—H基,通过氢原子能与其邻位上硝基的氧原子钳环化,却不能再同水的氢原子形成氢键,因此溶解度减小,而且易被水蒸气蒸馏出去。邻位与对位硝基苯酚在20 ℃的水里的溶解度之比为0.39。钳环化的化合物在非极性溶剂里,其溶解度与上述情况相反。
(3)对酸性的影响
如苯甲酸的电离常数为K,则在邻位、间位、对位上带有羟基时,电离常数依次为15.9K、1.26K和0.44K。如左右两边邻位上各取代一羟基,则电离常数为800K。这是由于邻位上的羟基与苯甲酸根生成带氢键的稳定的阴离子,从而增加了羧基中氢原子的电离度。


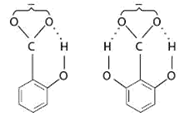

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。【定义】又称离子有效半径,是通过实验测定的。一般认为的离子半径是:离子晶体中相邻...
关于117号元素是金属元素还是非金属元素的讨论以下几种意见: 1、非金属元素 虽然根据...
氢是元素周期表中的第一号元素,元素名来源于希腊文,原意是水素。氢是由英国化学家卡...
在我们身边的物质世界中,有气体,有液体,也有固体。他们都是由许许多多的肉眼看不见...
...
碳位于第二周期ⅣA,氮位于第二周期VA,根据同周期元素气态氢化物的稳定性从左到右依...