
|
学习小专题 |

|
学习小专题 |
 [注解与辨疑a] 非金属氢化物规律介绍 作者:郝军 来源:未知 日期:2016-01-24 18:26:16 点击:13667 所属专题:氢化物
[注解与辨疑a] 非金属氢化物规律介绍 作者:郝军 来源:未知 日期:2016-01-24 18:26:16 点击:13667 所属专题:氢化物
在非金属元素中,除零族元素外,多数都能与氢以共价键结合,形成氢化物。其中,C、Si、B等还能形成一系列氢化物。这里要讨论的是非金属最简单的氢化物,如下表所列: IVA VA VIA VIIA CH 4 NH 3 H 2 O HF SiH 4 PH 3 H 2 S HCl A sH 3 H 2 Se HBr H 2 Te HI 以上氢化物...
 [注解与辨疑a] 元素的化合价与原子结构的关系 作者:王宗峰 来源:未知 日期:2012-12-03 10:12:39 点击:12417 所属专题:化合价
[注解与辨疑a] 元素的化合价与原子结构的关系 作者:王宗峰 来源:未知 日期:2012-12-03 10:12:39 点击:12417 所属专题:化合价
元素的化合价是一种元素一定数目的原子跟其他元素一定数目的原子化合的性质。元素的化合价和元素的原子结构,特别是最外层电子有密切的关系。 在离子化合物里,元素的化合价的数值就是这种元素的一个原子得失电子的数目。在共价化合物里,元素的化合价的数值就是这种元...
 [注解与辨疑a] 浅谈最外层电子的作用 作者:邵磊 来源:未知 日期:2016-01-24 19:30:19 点击:15568 所属专题:最外层电子 价电子
[注解与辨疑a] 浅谈最外层电子的作用 作者:邵磊 来源:未知 日期:2016-01-24 19:30:19 点击:15568 所属专题:最外层电子 价电子
一、最外层电子可以确定物质的化学键类型 一般说来,最外层电子数大于4的原子与最外层电子数小于4的原子彼此间容易得失电子形成阴阳离子,离子间以静电吸引力作用而形成离子键(如NaCl);最外层电子数大于或等于4的原子间容易共用电子对而形成共价键(如N≡N,C-C);...
 [探讨与扩展1] 相对原子质量介绍 作者:孙远征 来源:未知 日期:2016-01-17 11:01:32 点击:10890 所属专题:原子量
[探讨与扩展1] 相对原子质量介绍 作者:孙远征 来源:未知 日期:2016-01-17 11:01:32 点击:10890 所属专题:原子量
旧称原子量。19世纪初J.道尔顿在提出原子学说的同时就提出了原子量概念。他将氢原子量定为1.0,并以此做标准,根据物质质量组成及假定其中原子个数比,如把水中氢和氧原子个数比定为1∶1,然后对比得出其他元素原子量。 1803年他发表了世界上第一张原子量表。因为氧的化...
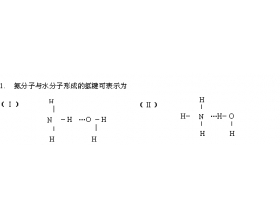 [注解与辨疑a] 氢键中的两个问题集 作者:徐俊龙 来源:浙江省慈溪市观城中学 日期:2024-03-13 08:36:00 点击:9479 所属专题:氢键与熔沸点
[注解与辨疑a] 氢键中的两个问题集 作者:徐俊龙 来源:浙江省慈溪市观城中学 日期:2024-03-13 08:36:00 点击:9479 所属专题:氢键与熔沸点
1. 为什么 HF 分子间氢键比 H 2 O 分子间氢键强,而 HF 的沸点却比 H 2 O 的低? 由于氟原子半径比氧原子小,电负性大于氧,所以 HF 分子间的 F - H … F 氢键比 H 2 O 分子间的 O — H … O 氢键要强得多,前者键能为 28KJ/mol, 后者 18.8KJ/mol 。即使在气态时, HF ...
 [注解与辨疑a] 走出理解原子结构的八个误区 作者:吴润生 来源:未知 日期:2013-04-17 15:51:50 点击:18825 所属专题:原子结构03
[注解与辨疑a] 走出理解原子结构的八个误区 作者:吴润生 来源:未知 日期:2013-04-17 15:51:50 点击:18825 所属专题:原子结构03
1. 能量最低原理就是电子首先填充到能量最低的轨道中去 能量最低原理是指基态原子核外电子的排布力求使整个原子的能量处于最低状态。不能将能量最低原理简单地理解成就是电子首先填充到能量最低的轨道中去。整个原子的能量也不能机械地看做各电子所处轨道的能量之和。因...
 [注解与辨疑a] 元素周期表中的特殊性 作者:龙立球 来源:未知 日期:2022-02-21 16:40:23 点击:11398 所属专题:元素推断 元素周期表规律
[注解与辨疑a] 元素周期表中的特殊性 作者:龙立球 来源:未知 日期:2022-02-21 16:40:23 点击:11398 所属专题:元素推断 元素周期表规律
元素周期表中的某些元素呈现的特殊性,常常作为解题的突破口,很有必要进行归纳。 1.大多数元素在自然界中有稳定的同位素,但Na、F、P、Al等元素却未被发现稳定的同位素。 2.元素周期表每个周期不一定都是从金属元素开始,如第一周期是从氢元素开始。 3.由不同种分子...
 [注解与辨疑a] 同位素简单表述 作者:陈功健 来源:未知 日期:2012-04-09 17:01:08 点击:6432 所属专题:同位素
[注解与辨疑a] 同位素简单表述 作者:陈功健 来源:未知 日期:2012-04-09 17:01:08 点击:6432 所属专题:同位素
具有相同原子序数的同一化学元素的两种或多种原子之一,在周期表上占有同一位置,化学行为几乎相同,但原子质量或质量数不同,从而其质谱行为、放射性转变和物理性质(例如在气态下的扩散本领)有所差异。同位素的表示是在该元素符号的左上角注明质量数 具有相同质子数,不同中子...
 [注解与辨疑a] 元素周期律和元素周期表的重要意义 作者:刘明 来源:未知 日期:2012-04-09 16:03:55 点击:8998 所属专题:元素周期律 元素周期表应用
[注解与辨疑a] 元素周期律和元素周期表的重要意义 作者:刘明 来源:未知 日期:2012-04-09 16:03:55 点击:8998 所属专题:元素周期律 元素周期表应用
元素周期律和周期表,揭示了元素之间的内在联系,反映了元素性质与它的原子结构的关系,在哲学、自然科学、生产实践各方面,都有重要意义。 1、在哲学方面,元素周期律提示了元素原子核电荷数递增引起元素性质发生周期性变化的事实,从自然科学上有力地论证了事物变化的量变...
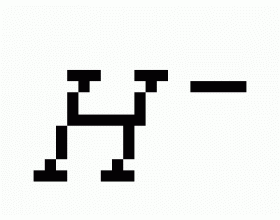 [注解与辨疑a] 元素周期表有关知识归纳、总结 作者:邬兆宇 来源:未知 日期:2014-12-18 09:43:42 点击:12356 所属专题:元素周期表
[注解与辨疑a] 元素周期表有关知识归纳、总结 作者:邬兆宇 来源:未知 日期:2014-12-18 09:43:42 点击:12356 所属专题:元素周期表
一. 主族元素的判断方法:符合下列情况的均是主族元素 1. 有1~3个电子层的元素(除去He、Ne、Ar); 2. 次外层有2个或8个电子的元素(除去惰性气体); 3. 最外层电子多于2个的元素(除去惰性气体); 4. 全部非金属元素。 二. 电子层结构相同的离子或原子(指核外电子...
 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。人教版高中化学必修第一册2019年6月第1版2024年7月第8次印刷P 10 3 讲解卤素单质与氢...
冰在0℃开始融化。这是本家都熟悉的事儿。 然而,世界上竟有热冰它在3.8℃方才融化! ...
1. 为什么 HF 分子间氢键比 H 2 O 分子间氢键强,而 HF 的沸点却比 H 2 O 的低? 由于...
1、为什么氧、氟没有最高正价?(朱朝宇) 氟是非金属性最强的元素,理论上没有哪种物...
1.如何理解分子间作用力的本质也是静电作用? 首先,在极性分子与极性分子之间,存在...
【关于化学键(Chemical bond)】: 化学键(Chemical bond)实质上是电性的微观作用...
...
准金属(metalloid),又称为半金属(semimetal),介于金属和非金属之间的物质。准金...