
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
1.无机物制备应遵循的原则
(1)反应原理正确;
(2)反应条件不苛刻,便于操作;
(3)原料来源丰富、易得;
(4)所制得的产物较纯净或易于分离提纯,污染小。
2.常见气体的实验室制备
综合分析1995年以来的高考试题(包括:全国卷、上海卷等测试题),单纯的气体制备实验题已不多见,但以气体制备为主线的实验设计题和综合实验题屡见不鲜。所以中学课本中要求掌握的常见气体制备的有关知识,如:反应原理、实验装置(包括:发生、净化、干燥装置)和药品、操作步骤(包括:仪器的组装顺序和操作顺序)、气体的收集和检验(或验满)等务必全面、熟练掌握,这也是准确、迅速解答有关实验设计题和综合实验题必不可少的基础知识。
(1)气体发生装置的四种典型类型:中学化学中要求掌握约13种气体的制备,它们是:三种单质气体(O2,H2,Cl2)、三种氢化物(HCl,H2S,NH3)、三种有机气体(CH4,C2H4,C2H2)、四种氧化物(CO2,SO2,NO,NO2)。
从反应物的状态和反应时是否需要加热,可把气体的发生装置归纳为如下四种类型:
①固—固加热型:如图 5-11,可制取O2,NH3,CH4等。
②固—液不加热型:如图5-12或图5-13,图5-12可制取H2,CO2,H2S,NO2,C2H2等;图5-12只可制取H2,CO2,H2S(注意启普发生器使用时的三个条件)。
③固—液或液—液加热不控温型:如图5-14可制Cl2,HCl,SO2,CO,NO等。
④液—液加热控温型:如图5-15,可制C2H4等。
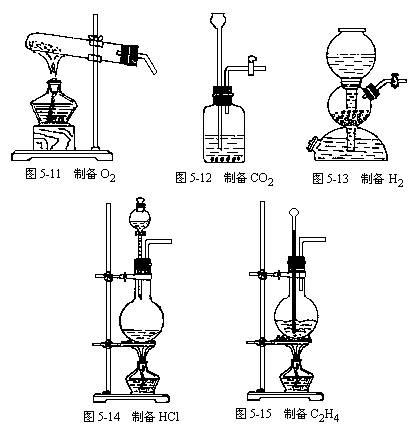
(2)气体的收集如图5-16:
①排水集气法:难溶或微溶于水,且与水不发生反应的气体,均可用排水集气法收集。用排水集气法收集气体时,导管只能伸入集气瓶内少许。
②排空气集气法:不与空气发生反应,且其密度与空气的密度相差较大的气体,均可用排空气集气法收集。空气的平均式量约为29,则式量大于29的气体如Cl2等用可瓶口向上排空气法收集;式量小于29的气体如H2等可用瓶口向下排空气法收集;而与空气密度相近的气体如NO、CO等不能用排空气法收集。
用排空气法收集气体时,导管一定要接近集气瓶底部,把空气尽量排出;为减少空气向瓶内扩散,集气瓶口应盖上毛玻璃片;如用试管收集时,可在管口轻轻塞入一小团疏松的棉花。
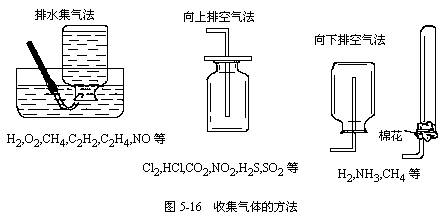
(3)几种气体的制备原理,见表5-4。
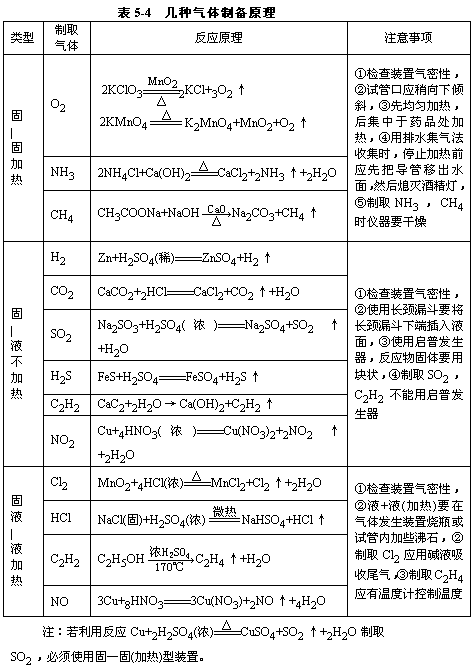
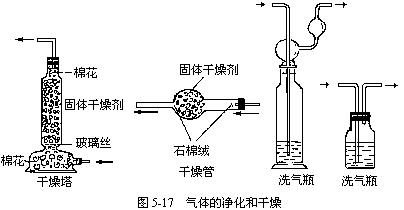
(4)气体的净化:选择气体吸收剂应根据气体的性质和杂质的性质而确定,所选用的吸收剂只能吸收气体中的杂质,而不能与被提纯的气体反应,见表5-5。一般情况下:①易溶于水的气体杂质可用水吸收;②酸性气体杂质可用碱性物质吸收;③碱性气体杂质可用酸性物质吸收;④水蒸气可用干燥剂来吸收;⑤能与杂质反应生成沉淀(或可溶物)的物质也可用作吸收剂。
(5)常见气体的干燥:在选择干燥剂时,一般应注意以下几点(见表5-6)。
①被干燥的气体一定不能与干燥剂发生化学反应。
②酸性干燥剂一般用来干燥酸性或中性气体,而不能用来干燥碱性气体。如浓H2SO4能干燥H2,O2,Cl2,CO2等,而不能干燥NH3;反之,碱性干燥剂也不能干燥酸性气体,如碱石灰不能干燥Cl2,CO2,HCl等。
③具有强氧化性的浓H2SO4不能用来干燥还原性气体,如H2S,HBr, HI;对于H2,CO等虽具有较强的还原性,但反应条件是加热或高温,故常温下仍可使用浓H2SO4干燥。
④无水CaCl2呈中性,对各类气体一般均可干燥,但NH3能与其发生络合作用而不能使用。反应式为:CaCl2+8NH3 ![]() CaCl2·8NH3
CaCl2·8NH3

(6)关于气体的净化与干燥的先后顺序:
①若采用溶液除杂,一般是除杂在先,干燥在后。其原因是:气体通过溶液将带出水蒸气,干燥剂可除去这些水蒸气。例如实验室中利用大理石与稀盐酸反应制备CO2,欲制得干燥、纯净的CO2,可先将产生的气体通过饱和的NaHCO3溶液,除去混入其中的HCl气体,再通过浓H2SO4除去水蒸气。
②若采用加热除杂,则一般是干燥在先。例如N2中混有O2,CO2,H2O(气),可先将混气通过碱石灰,除去CO2和H2O(气),再将从干燥管导出的气体通过装有灼热Cu网的硬质玻璃管,除去O2,即可得到干燥、纯净的N2。若将混气先通过灼热的Cu网,因气体中混有水蒸气,易引起试管破裂。
(7)关于“尾气的处理”操作中应掌握的几个问题:
①对有毒、有害的气体必须用适当的溶液予以吸收,或点燃变为无毒、无害的气体,再排放到空气中。如Cl2、SO2、Br2(蒸气)、NO2等,可用NaOH溶液吸收;H2S可用CuSO4或NaOH溶液吸收; NH3可用浓H2SO4吸收;而CO尾气,则可在导管口处点燃,将其转化为CO2。
②若需检验某混气中含有大量H2和CO,先将混气通过灼热的CuO,使其分别转化为H2O(气)和CO2,然后通过装有无水CuSO4的U形管(或干燥管),再通过澄清石灰水进行验证(该顺序不能颠倒)。
③放空:针对无毒、无害气体的排出。如:N2,O2,H2,CO2等(可在塞子上安装一个放空管或多打一个孔)。
④对于制备在空气中易水解的物质,如:Mg3N2、Al2S3、 SnCl4、无水CuCl2、无水AlCl3等,应在尾气处理装置以后再连接一个干燥装置,目的是防止空气中水蒸气进入制备装置。
(8)气体的净化与干燥装置如图5-17。
3.掌握几种重要有机物
溴苯、硝基苯、乙酸乙酯、酚醛树脂的制备原理、反应装置、试剂的用量及添加次序和反应进行的条件,并能准确描述有关实验现象。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。
 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。
一、实验方案的设计与评价的一般原则 一个相对完整的化学实验...
一、无水盐的用途 无水盐在化学合成中有很多应用,比如做反应...
化学实验方案的设计是指在实施化学实验之前,根据化学实验的...
探 究 实 验 1、含有酚酞的氢氧化钠的溶液中,滴加新制氯水,...
化学实验方案设计的基本要求; (2)一个相对完整的化学实验方案...
玻璃仪器上所标的刻度存在区别,有的仪器“0”刻度在仪器下方...