
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
一、化学键的极性
分子的极性是由化学键的极性产生的:
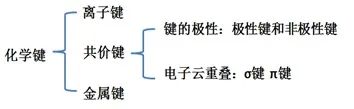
非极性键:成键的两个原子电负性相同,共用电子对不偏移。
极性键:成键的两个原子电负性不同,共用电子对偏移。
成键的两个原子的电负性差越大,键的极性越大;若电负性差超过1.7,可以认为该化学键是离子键;因此,离子键可以看成是极性很强的共价键。(1.7为平均值,不一定适用所有物质)
二、分子的极性
非极性分子:分子中的正、负电荷中心重合。
极性分子:分子中的正、负电荷中心不重合。
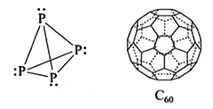
分子极性是由键的极性产生。只有非极性键的分子一定是非极性分子(如P4、C60),含有极性键的分子要看是否因结构对称而抵消了键的极性。
三、如何判断极性分子与非极性分子:
1、电荷中心法:正负电荷中心重合为非极性分子,否则为极性分子。
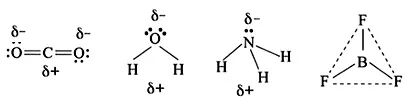
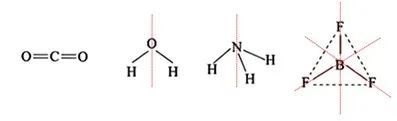
如:CO2分子中碳原子带正电荷,两个氧原子带负电荷,正负电荷中心重合,故为非极性分子。H2O分子氧原子带负电荷,两个氢原子带正电荷,正负电荷中心不重合,为极性分子。NH3为三角锥形,为极性分子;BF3为平面正三角形,为非极性分子。
2、向量和法:所有键的极性向量和为0的分子为非极性分子。
衡量极性的物理量叫偶极矩(μ):μ= q·d ,其中q为带电量, d为距离。
偶极矩是有方向的。分子的偶极矩是分子中所有键的偶极矩向量和。
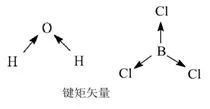
3、对称法:对称性好、键的极性相互抵消了的分子为非极性分子,否则为极性分子。
对称性好包括:(1)中心对称(2)两条及以上对称轴的轴对称
4、孤对电子法(ABn型): A无孤对电子的为非极性分子,否则为极性分子。
如:CO2、CH4、PCl3 、PCl5、SO2、SO3、SF6
解释:若没有孤电子对,几个共价键电子对互相排除能达到非常均匀对称状态;一旦有孤电子对后,相当于有了额外的作用力,导致分子没有非常好的对称性。
5、化合价法(ABn型): A的化合价绝对值 = A最外层电子数。
如:CO2、CH4、PCl3 、PCl5、SO2、SO3、SF6
CO2和CH4中碳的化合价分别为+4和-4,碳最外层为4个电子,故均为非极性分子。
PCl3和PCl5中磷的化合价分别为+3和+5价,磷最外层电子数为5,故PCl3为极性分子,PCl5为非极性分子。
解释:若中心原子的化合价充分利用,就没有孤电子对了,故与上方法同。
6、相似相溶原理:由极性分子组成的溶质容易溶解于极性分子组成的溶剂中,由非极性分子组成的溶质容易溶解于非极性分子组成的溶剂中。
如:I2易溶于CCl4中,难溶于水中,是因为I2 、CCl4是非极性分子,水是极性分子。
相似相溶原理是一个经验规则,不一定能解释所有问题。
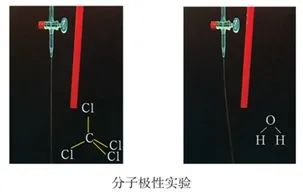
7、滴液法。
在酸式滴定管中加入四氯化碳,打开活塞让四氯化碳缓缓流下,可看到四氯化碳呈直线状垂直流入烧杯中。将用毛皮摩擦过的橡胶棒靠近四氯化碳液流,观察到四氯化碳的流动方向没有发生变化;再向另一酸式滴定管中加入蒸馏水,进行同样的实验,观察到水的流动方向发生变化。因为水分子为极性分子,在电场的作用下,分子重新取向排列,与电场之间产生作用力而偏转流向。CCl4为非极性分子,不能重新取向排列,就没有产生作用力。
四、比较(结构类似)分子极性的大小
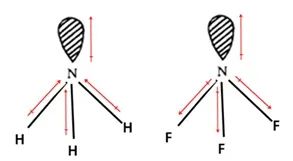
例1:比较NH3、NF3的极性大小。
分析: 电负性差△X(NH3)=|XN-XH|=0.9,△X(NF3)=|XN-XF|=1.0,按说两分子的极性相近,但是两个分子的极性相差很大。NH3分子中孤电子对偶极方向与N-H偶极方向一致,总的极性加强;而在NF3分子中,孤电子对偶极方向与N-F偶极方向相反,导致极性大部分抵消,故NF3分子极性很小。因此,分子的极性:NH3> NF3
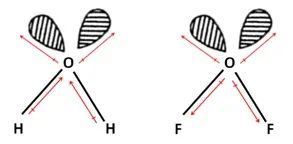
例2:比较H2O、OF2的极性大小: H2O > OF2

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。
 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。
冠醚是一类大环多醚化合物,其分子结构呈环状,环上均匀分布...
在高考备考化学试卷里,经常会遇到含钯的催化剂。本文将就钯...
在离子晶体中存在离子极化现象,使得离子键带有一定共价键的...
【情境】:你注意到我们每天都离不开的水有什么反常之处吗?...
氢键的大小(强度)可以通过多种因素来比较,这些因素包括氢键...
...