
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
一、铬
1、铬的物理性质:
银白色金属,由于单电子多,金属键强,故硬度及熔点均高,是硬度最高的过渡金属。由于铬的机械强度好,且有抗腐蚀性能,被用于钢铁合金中。不锈钢中含铬量最高,可达20%左右。许多金属表面镀铬,防锈,光亮

2、铬的存在和制取
①存在:铬在自然界中以铬铁矿存在,化学式为Fe(CrO2)2
②制取:金属铬可以通过铬铁矿FeCr2O4制取,用焦炭还原就可制得铬铁合金。该合金可用作制取不锈钢的原料。
FeCr2O4+4C Fe+2Cr+4CO。
Fe+2Cr+4CO。
如果要制取不含铁的铬单质,可将铬铁矿与碳酸钠强热而成为水溶性的铬酸盐(其中铁转换为不溶性的Fe2O3),进一步用水浸取、酸化使重铬酸盐析出。接着加热还原而变为Cr2O3,再用铝等还原就可得到金属铬
3、铬的化学性质
①室温下化学性质稳定,潮湿空气中也不会被腐蚀,因此常被用于制作不锈钢和镀铬
②铬比较活泼,能溶于稀HCl、H2SO4,起初生成蓝色Cr2+溶液,而后为空气所氧化成绿色的Cr3+溶液
铬缓慢地溶于稀盐酸和稀硫酸中,先有铬(II)生成:Cr+2HCl===CrCl2(蓝色)+H2↑
铬(II)在空气中迅速被氧化成铬(III):4CrCl2+4HCl+O2===4CrCl3(绿色)+2H2O
③铬在冷、浓HNO3中钝化
二、铬的化合物


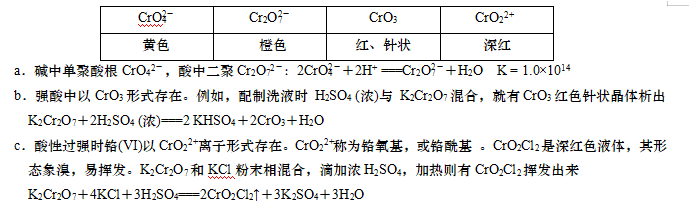


 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。
 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。
锰(Mn)是元素周期表第四周期第 ⅦB 族的过渡金属元素,原子...
镁(Mg,原子序数 12,第 ⅡA 族碱土金属元素)是典型的活泼金...
在第ⅡA族(碱土金属)元素家族中,铍(Be)以其极致的轻金属特性、...
1.皓矾: ZnSO 4 ·7H 2 O 2.钡餐,重晶石: BaSO 4 3.绿矾,皂矾,青矾...
少量、适量、足量和过量,这几个词是化学实验和计算中的核心...
一、基础概念:从 “温度强度” 看五者的核心差异 首先需明确...