
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
一、氯气
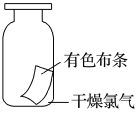
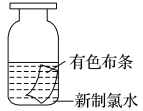
(一)氯元素的存在 1、氯的原子结构及存在 (1)卤族元素: F、Cl、Br、I、At、Ts (2)价电子排布式:ns2np5 ①化合价:最高正价为+7(氟无正价),最低负价为-1 ②成对电子数:1 ③形成共价键个数:1 (3)原子结构: 2、单质的结构和性质 (1)晶体类型:分子晶体 (2)作用力:范德华力 (3)熔沸点:相对分子质量越大,熔沸点越高 3、氯元素的存在: 氯在自然界中以化合态存在,除了以NaCl、MgCl2、CaCl2等形式大量存在于海水中,还存在于陆地的盐湖和盐矿中 (二)Cl2的物理性质: 1、溶解性 (1)水溶性:在水中溶解度较小,得到卤水 (2)易溶于酒精、苯、分馏汽油、四氯化碳等有机溶剂 (3)氯气不溶于饱和氯化钠溶液 2、物理特性: Cl2易液化,Br2易挥发,I2易升华 3、颜色 氯 溴 碘 单质 黄绿色 深红棕色 紫黑色 卤水 浅黄绿色 橙色 褐色 有机溶剂 黄绿色 红棕色 紫红色 4、元素存在:在自然界中全部以化合态存在 5、卤素的保存 (1)液氯:常存放干燥的钢瓶中 (2)卤水:放在棕色瓶中,阴暗处密封保存 (3)溴的保存 ①密封:防止溴挥发出来 ②液封:瓶中加少量水做液封,以减少挥发 ③瓶塞:不能用橡胶塞,而应用玻璃塞 (三)化学性质: 氯原子最外层有7个电子,在化学反应中容易易得到1个电子,使最外层达到8个电子的稳定结构。因此氯气是很活泼的非金属单质,具有强氧化性 1、Cl2与金属单质的反应: Cl2能与绝大多数金属能反应,且变价金属(如Fe)一般能氧化到最高价 (1)与钠反应: (反应现象:产生大量白烟,火焰为黄色) (2)与铁反应: (反应现象:产生大量棕黄色烟) (3)与铜反应: (反应现象:产生大量棕黄色烟) 2、Cl2与非金属单质的反应 (1)与氢气反应 (反应现象:H2在Cl2中能安静地燃烧,发出苍白色火焰,瓶口有白雾) 用于工业制盐酸 (反应现象:剧烈反应,会发生爆炸,瓶口有白雾) 不能用于工业制盐酸 (2)与磷的反应 (Cl2不足) (三氯化磷是液体,呈雾状) (Cl2充足) (五氯化磷是固体,呈白烟状) 反应现象:磷在氯气中剧烈燃烧,在集气瓶口产生大量白色烟雾 (3)与硅的反应: 3、Cl2与水的反应 常温下,溶于水中的部分氯气会与水反应,反应的化学方程式为: Cl2+H2O===HCl+HClO,该反应中的氧化剂为Cl2,还原剂为Cl2,为歧化反应。 生成物中次氯酸(HClO)具有强氧化性,能杀死水中的病菌,起到消毒作用,目前,很多自来水厂用氯气来杀菌、消毒。 近年来有科学家提出,使用氯气对自来水消毒时,氯气会与水中的有机物发生反应,生成的有机氯化物可能对人体有害。 所以国家规定了饮用水中余氯含量标准,而且已经开始使用新的自来水消毒剂,如二氧化氯(ClO2)、臭氧等 实验操作 实验现象 实验结论 有色布条不褪色 干燥氯气不具有漂白性 有色布条褪色 新制氯水具有漂白性 微点拨 干燥氯气无漂白性,新制氯水具有漂白性,实际起漂白作用的是HClO 4、Cl2与碱的反应 (1)与氢氧化钠溶液反应——制取漂白液 ①化学方程式: ——主要用来吸收多余Cl2 ②离子方程式: ③漂白液的主要成分是氯化钠和次氯酸钠,有效成分是次氯酸钠,是混合物 (2)与石灰乳反应——制取漂白粉 化学方程式: —工业通常是将Cl2通入石灰乳中用来制取漂白粉 注意事项: ①工业上为什么用Cl2来制取漂白粉? 形成比次氯酸更稳定的比次氯酸盐,便于运输、保存 ②漂白粉的主要成分是CaCl2、Ca(ClO)2,有效成分是Ca(ClO)2,漂粉精的主要成分是Ca(ClO)2 ③漂白反应原理: (强酸制弱酸,用盐酸也能反应) ④Ca(ClO)2易于CO2、H2O反应,生成的HClO见光易分解,所以漂粉精、漂白粉都要密封包装,避光、隔潮存放 ⑤漂白液、漂白粉、漂粉精既可作漂白棉、麻、纸张的漂白剂,又可作游泳池及环境的消毒剂 ⑥在常温下,Cl2与碱反应的化学方程式一般为:Cl2+碱===次氯酸盐+金属氯化物+水。但在加热的条件下,Cl2与氢氧化钠溶液的反应为: (热碱溶液中) ⑦Cl2与碱反应时: 1 mol Cl2与足量NaOH反应转移电子数为Na ⑧Ca(ClO)2与浓HCl反应: Ca(ClO)2与稀HCl反应: 向NaCl和NaClO的混合溶液通入稀硫酸: ⑨漂白粉长期露置于空气中,最终会生成氯化钙而失效,有关反应的化学方程式 5、Cl2与还原性物质反应 ①Cl2与FeCl2溶液反应: (除去FeCl3中FeCl2) ②Cl2与KI溶液反应: (氯气的检验:湿润的淀粉碘化钾试纸变蓝) ③Cl2与SO2的水溶液反应: ④与Na2S反应:(氧化性:Cl2﹥S) ⑤与H2O2反应: ⑥与NH3反应: (检验输氯管道是否发生泄漏) (四)Cl2的用途 1、消毒剂、漂白剂、制漂白液、漂白粉、漂粉精——氯气溶于水生成HClO具有强氧化性 2、有机合成,有机化工,如合成塑料、橡胶、人造纤维、农药、燃料、药品等 3、制高纯度的半导体(Si),高纯度的金属钛 4、制盐酸 (五)氯气的实验室制备 1、实验室制备氯气的反应原理 (1)方法1: (2)方法2:若无浓盐酸,可用NaCl和浓H2SO4代替: (3)方法3:反应物若无MnO2,可用其他强氧化剂如KClO3、Ca(ClO)2、KMnO4等代替: 2、实验仪器: 铁架台、酒精灯、石棉网、圆底烧瓶、分液漏斗、导气管、洗气瓶、集气瓶 3、实验装置 (1)发生装置:用分液漏斗、圆底烧瓶等组装的固液加热型制气装置。 (2)净化装置:先用饱和食盐水除去Cl2中的HCl气体,再用浓硫酸除去Cl2中的水蒸气。 (3)收集装置:向上排空气法或排饱和食盐水法。 选用收集方法的主要依据是气体的密度和水溶性。因为氯气能溶于水,密度比空气大,所以收集氯气时,不能用排水法,应该用向上排空气法。Cl2在饱和食盐水中的溶解度较小,也可用排饱和食盐水法收集Cl2 (4)尾气处理:用 NaOH溶液吸收多余的Cl2,以防Cl2污染空气。 氯气有毒,实验室制取氯气时应在密闭系统或通风橱中进行,通常在收集装置的后面连接盛有NaOH溶液的吸收装置 4、验满方法 (1)将湿润的淀粉−碘化钾试纸靠近收集Cl2的集气瓶瓶口,若观察到试纸立即变蓝,则证明已收集满。 (2)将湿润的蓝色石蕊试纸靠近盛氯气的瓶口,若观察到试纸先变红后褪色,则证明已收集满。 (3)根据氯气的颜色判断是否收集满:若观察到整个集气瓶中充满黄绿色的气体,则证明已收集满。 5、实验室制取氯气的注意事项 (1)为了减少制得的Cl2中HCl的含量,加热时温度不宜过高,以减少HCl的挥发。 (2)制取时一定要注意反应条件是“浓盐酸”和“加热”,一旦浓盐酸变为稀盐酸,反应将不再发生。 (3)尾气吸收时,不能用澄清石灰水吸收Cl2,因为澄清石灰水中Ca(OH)2浓度小,吸收不完全。工业上常采用石灰乳来吸收Cl2。 (4)必须用浓盐酸,MnO2与稀盐酸不反应,且随着反应的进行,盐酸浓度变小,无论MnO2是否足量,盐酸均不能完全反应,反应后的溶液为盐酸和MnCl2的混合液 (5)浓盐酸中,部分Cl-的化合价升高,4 mol HCl参加反应,被氧化的Cl-为2 mol (6)实验结束后,先使反应停止并通入无害气体,如氮气排出装置中残留的Cl2,再拆卸装置,避免污染空气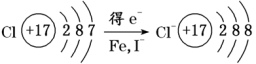
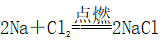
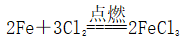
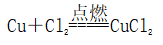
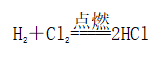

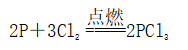
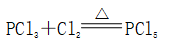
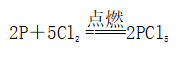
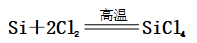
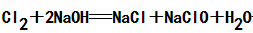
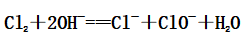
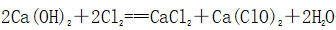
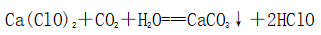
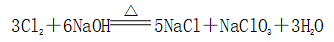
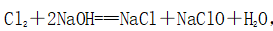 ,
,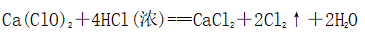
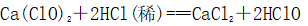
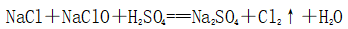
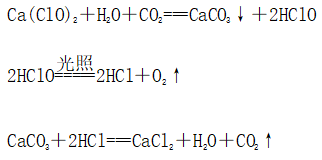
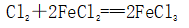
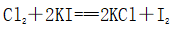
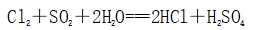

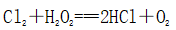
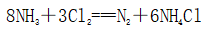
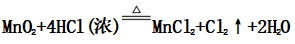
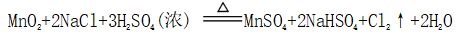
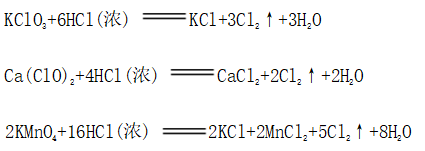
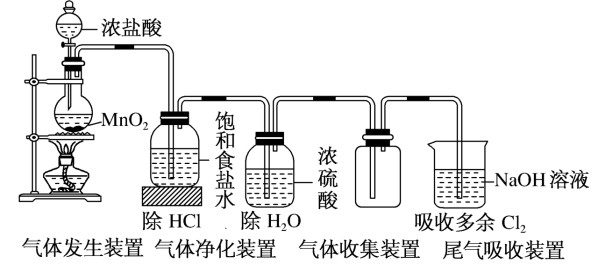
二、次氯酸和次氯酸盐
1、次氯酸
(1)结构式:H-O-Cl,
电子式
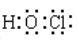
(2)不稳定性:
![]()
(3)弱酸性;比碳酸弱
①酸的酸性:H2CO3>HClO>HCO3-
②盐的碱性:HCO3-<ClO-<CO32-
(4)强氧化性
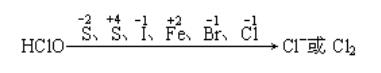
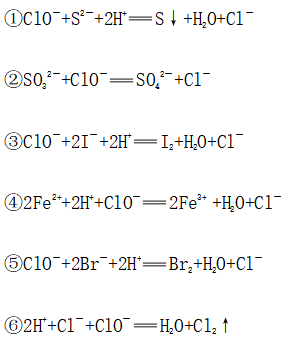
(5)漂白性:氧化性、永久性和选择性
①有色布条![]() 褪色
褪色
②石蕊试液先变红,后褪色
③碳素墨水不褪色
2、84消毒液
(1)制备
①常规制备:Cl2+2NaOHNaCl+NaClO+H2O
②电解制备:

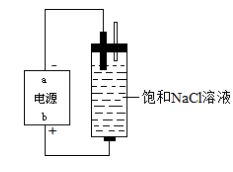
(2)主要成分:NaClO和NaCl,有效成分NaClO
(3)消毒原理:NaClO+H2O+CO2==NaHCO3+HClO
(4)ClO-的强氧化性
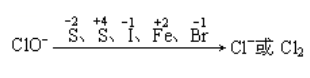
3、漂白粉
(1)制备
①化学反应:
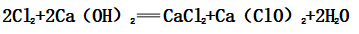
②离子反应:
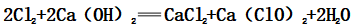
(2)主要成分:CaCl2和Ca(ClO)2,有效成分:Ca(ClO)2
(3)漂白原理:
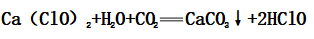
(4)变质
①变质过程:
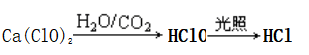
②最终产物:在空气中长期放置最终生成的固体是CaCO3
③检验变质:取固体药品,加入稀盐酸,有气泡产生
(5)水解
①离子反应:
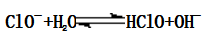
②加热蒸干:
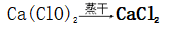
③Ca(ClO)2石蕊试液先变蓝,后褪色
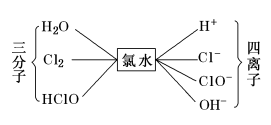
二、氯水的成分和性质——从平衡的角度理解
氯气能溶于水(1∶2),氯气的水溶液称为氯水,溶于水的氯气只有少量与水反应。
1、氯水中存在三种平衡关系
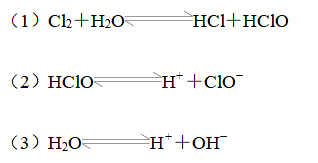
[归纳拓展]
![]() 平衡移动的应用
平衡移动的应用
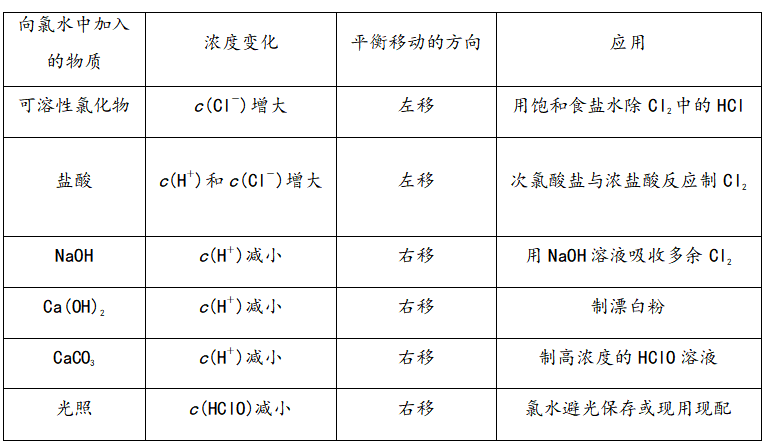
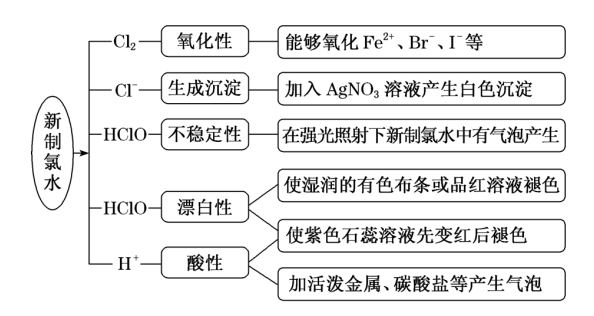
2、氯水性质的多重性
新制氯水的多种成分决定了它具有多重性质,在不同的化学反应中,氯水中参与反应的微粒不同。
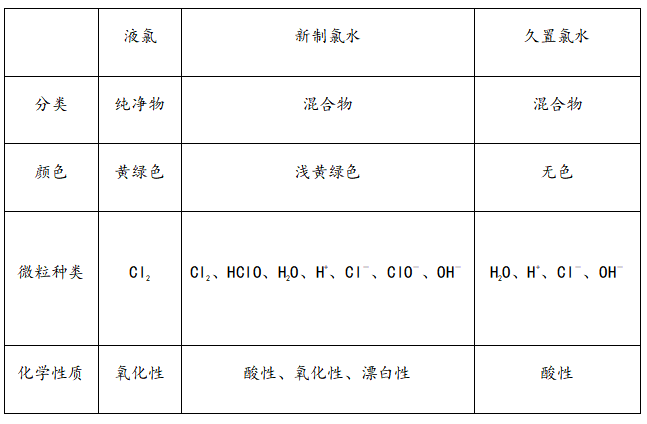
3、液氯、新制氯水、久置氯水的比较

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。一 、 次氯酸 和 次氯酸盐 1、次氯酸 (1)结构式: H-O-Cl ,电子式 (2)不稳定性...
一、氯气 1 、氯气的发现和确认 【教材阅读】( 1 )舍勒:瑞典化学家,用软锰矿(主...
...
...
...
一、什么是消毒剂呢? 化学消毒剂是指用于杀灭传播媒介上病原微生物,使其达到无害化...