
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
1、将饱和FeCl3溶液滴入沸水中加热煮沸可制得Fe(OH)3胶体,那么,能否用加热的方法使 制得的Fe(OH)3股体凝聚?
答:由于加热胶体运动速度加快,碰撞接触的机会增多,同时也降低了胶粒对离子的吸附作用, 减少了胶粒所带电荷,使胶体发生凝聚。FeCl3饱和溶液滴到沸水中发生如下反应:
FeCl3 +3H2O Fe(OH)3 (胶体)+3HC1 使溶液中存在一定浓度的盐酸,由于盐酸的存在抑制了 FeCl3的进一步水解,因此,加热较长时间也难使Fe(OH)3胶体凝聚,但若用渗析法把 Fe(OH)3胶体中大部分盐酸除去,则加热也能使之很快凝聚。
Fe(OH)3 (胶体)+3HC1 使溶液中存在一定浓度的盐酸,由于盐酸的存在抑制了 FeCl3的进一步水解,因此,加热较长时间也难使Fe(OH)3胶体凝聚,但若用渗析法把 Fe(OH)3胶体中大部分盐酸除去,则加热也能使之很快凝聚。
2、加入电解质,由于电解质电离生成的阳离 子或阴离子,中和了胶体微粒所带电荷,从而使胶体发生凝聚。Fe(OH)3胶体中,也含有大量阴离 子,为何不能使它凝聚?
答:外加电解质时,体系内离子总浓度大大地 增高,因此给带电的胶粒创造了吸引异性离子的 条件,胶粒原来所带电荷会减少甚至完全被中和,胶粒间斥力大大减少,以致胶粒互碰后引起聚集变大而迅速聚沉。电解质的聚沉能力主要由异性 (与溶胶粒子所带电荷符号相反)离子的价态决 定,离子价态愈高,电解质聚沉能力愈大。
加热煮沸FeCl3制得的Fe(OH)3溶胶的胶团 结构如下:
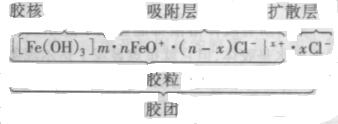
整个胶团是电中性的,从以上结构可看到, Fe(OH)3胶体中的Cl-(以水合离子的形式存在) 主要存在于胶粒的吸附层和胶团的扩散层中,起不到凝聚作用,并且吸附层中离子的水化作用,使 胶粒被水包围,也会阻止胶粒间的相互接近,增加 了其稳定性。
3、为何说丁达尔现象是胶体的特征现象? 是否所有胶体都能出现丁达尔现象?
答:丁达尔现象起源于光的散射。散射光的 强度随着颗粒半径增加而变化。一般讲,可见光波长为4×10-7m~ 8× 10 -7 m,胶体中分散质粒子 直径在10-7 ~ 10-9 m,一般是胶体分散质粒子直径小于入射光的波长,所以,当一束强光照射到胶体时,有一部分光被粒子散射,即从该粒子向各个方向传播,这时粒子本身好象一个发光体向各个方向发射出光线,胶体体系中无数个分散质粒子散射的结果,就产生了丁达尔现象。悬(浮)浊液 分散质微粒直径太大(一般大于10-7 m),对于入射光只有反射而不散射;溶液里溶质微粒太小(一 般小于10-9 m),对于入射光散射很微弱,观察不到丁达尔现象。所以说丁达尔现象是胶体的特征现象。
是否所有胶体溶液都能显现丁达尔现象呢? 碳素墨水是胶体,但它就很难显现丁达尔现象,这 是因为墨水中的黑色物质对可见光具有很强的吸 收作用。另外散射光的强度还随着微粒浓度减小而减小,若实验时溶胶浓度太稀也很难观察到明 显的丁达尔现象。
4、 淀粉、蛋白质等高分子在水中形成的分散系有时称为溶液,有时又称为胶体,为什么?
答:根据分散质微粒的大小可将分散系称为 溶液、胶体、浊液三类,但胶体与溶液的差异不仅 是分散质微粒大小的不同,还有其构造上的差异, 若分散质微粒是离子或单个分子,则这样的分散 系叫溶液。胶体中分散质的微粒结构比较复杂。
淀粉、蛋白质等都是以分子形式分散在水中 的,因此,形成的分散系都应叫溶液。只是由于这 些分子很大,已经达到胶体范围,具有胶体的一些 特征。如不能透过半透膜、有丁达尔现象,所以也 可称为胶体。
但胶体与高分子溶液毕竟有许多不同之处。 例如,高分子溶液稳定存在的原因不是胶粒带相同电荷互相排斥的结果,而是这些大分子高度溶 剂化的结果;高分子的溶解过程是可逆的,胶体的胶粒一旦凝聚出来,就不能或很难恢复原状;一般 说来,高分子溶液的粘度比胶体大。
5、为什么胶体凝聚是不可逆的,而蛋白质溶液的盐析是可逆的?
答:根据胶体微粒和分散剂之间的亲疏关系, 可把溶胶分为亲液溶胶(以水为分散剂的称为亲水溶胶)和憎液溶胶(题中所说胶体指的就是憎液溶胶)。前者包括淀粉、蛋白质等许多天然高分子溶液。后者包括金、银等金属和不溶性卤化物、氢 氧化物等溶胶。
两类溶胶都较稳定,但憎液溶胶的稳定性主要是由于胶粒带有相同电荷,微粒在接近到一定 距离时便发生静电斥力,阻止胶粒聚集。但是,如果往这种胶体里即使加人少量的电解质,由于电 解质电离生成的阳离子或阴离子中和了胶体微粒所带电荷,也能使胶体的微粒聚集成较大的颗粒, 形成沉淀而从分散剂里析出,这个过程叫凝聚,由 于沉淀物的溶解度很小,即使加水稀释沉淀也不会明显地溶解,因而不可逆。亲液溶胶的稳定性主要由于胶粒高度的溶剂化作用所致,与电荷无关。有机高分子带有大量的一OH、一COOH、 一NH2设等亲水基,这些基团的水化作用很强(即以 氢键和水分子结合),使有机分子外围有很厚的水化膜,阻止髙分子化合物的聚集。当往这类溶胶中加少量盐[如Na2SO4、(NH4)2SO4等],盐的离子反而被有机高分子选择吸附,使表层带电且彼此排斥,与水分子间的作用反而加强,因而使有机物的溶解度反而增大,这种现象称为盐溶;而加人浓的盐溶液,使水的活度降低,原来溶液中的大部分自由水转变为盐离子的水化水,从而降低了有机 髙分子的亲水基团与水分子间的相互作用,破坏 了表面的水膜,失去其保持稳定性的因素而发生 聚沉,这一过程叫盐析。向析出的沉淀中继续加入水时,使电解质的浓度减少,沉淀物会重新溶 解。
6、什么是胶体沉淀、凝胶和冻胶?
答:将胶体溶液加热或加人电解质,会使胶体溶液发生凝聚作用,凝聚作用的结果是分散在分散剂中的胶粒互相凝结为较大的颗粒从分散剂中析出,析出的物质叫做沉淀,为区别于晶体从溶液中析出,这种沉淀叫胶状沉淀。
生成胶状沉淀是胶体凝聚的一般形式,在一 些情况下胶体凝聚后胶粒和分散剂凝聚成一个整体,成为一种冻状物,这种冻状物叫凝胶。如豆腐 就是豆浆中的蛋白质和其它物质与水一起形成的一种凝胶,特点是加热时,它不能熔化为胶体,加 水后也不能恢复为胶体。
另有一种胶体凝结现象,这种凝结作用多发于分子胶体,在一定条件下,例如,当温度降低,胶体分散质浓度足够大时可以形成网状的结构而把全部的分散剂包络起来,形成一个整体,它也是一种胶冻状物质,称为冻胶。冻胶有时也被 称为凝胶,但它同前面所说的凝胶不同,它是可逆 的,采用加热或机械搅拌等方法可使它恢复为胶体,冷凝的淀粉糊、动物胶等都属于冻胶。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。
 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。
在中学化学教学中,为了便于初学者理解,常有“物质的状态变...
化学方程式“等号”上的条件是应试中常见的细节问题,学生经...
书写化学方程式难免涉及多个化学反应同时进行的情况。这些方...
⒈无氧酸(氢酸) 属于二元化合物中的氢酸的命名格式为氢某酸...
氧化物分类的核心逻辑是 “以化学性质为核心、结合组成 / 结构...
在物质分散系的分类中(溶液、胶体、浊液),丁达尔效应是胶...