
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
一、能斯特方程:
对于任何电对[Ox]/[Red],其电极反应:氧化型 (Ox)+e-=还原型(Red)
在非标准状态条件下,其电极电势可用能斯特方程计算:
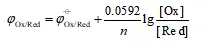
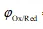 值越大,表明[Ox]型氧化能力越强,[Red]型还原能力越弱。
值越大,表明[Ox]型氧化能力越强,[Red]型还原能力越弱。
二、元素电势图:
一种元素的不同氧化数物种按照其氧化数由高到低从左到右的顺序排成一行,并在两种氧化数物种之间标出相应的标准电极电势值。这种表示一种元素各种氧化数之间标准电极电势的图式称为元素电势图,又称拉蒂默图。
元素电势图应用:
1、判断元素各种氧化数的相对稳定性(判断是否能发生岐化)
对某一元素,其不同氧化数的稳定性主要取决于相邻电对的标准电极电势值。若相邻电对的φθ值符合φθ右>φθ左,则处于中间的个体必定是不稳定态,可发生歧化反应,其产物是两相邻的物质。如
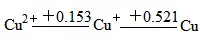
比较:φ左=φ[Cu2+/Cu+]=0.153V
φ右=[Cu+/Cu]=0.521V
φ左<φ右,则
电池的电动势为E=φ+-φ-=φ右-φ左,则
E>0,表示电池反应可自发进行,即中间物种可发生歧化反应。
正极电对:Cu+/Cu
负极电对:Cu2+/Cu+
表明[Cu+]氧化能力强,[Cu+]还原能力强,Cu+可发生歧化反应生成Cu2+和Cu。
若相反,φ左>φ右,则两边的不稳定,可发生逆歧化反应,两头的是反应物,产物是中间部分。如
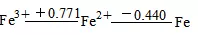
可以得出结论,在水溶液中Fe3+和Fe可发生反应生成Fe2+。
2、求未知电对的电极电势
利用Gibbs函数变化的加合性,可以从几个相邻电对的已知电极电势求算任一未知的电对的电极电势。
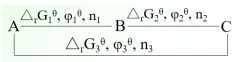
已知φ1θ和φ2θ,求φ3θ。
因为 ΔrG1θ=-n1Fφ1θ
ΔrG2θ=-n2Fφ2θ
ΔrG3θ=-n3Fφ3θ
由盖斯定律得, ΔrG3θ= ΔrG1θ+ΔrG2θ
其中n3=n1+n2
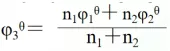
由铁的电势图:
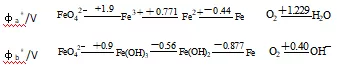
由于φaθ(O2/H2O)=1.229V >φaθ(Fe3+/Fe2+)=0.771V
φbθ(O2/OH-)=0.40V>φbθ[Fe(OH)3/Fe(OH)2]=-0.56V
因此,Fe(II)能被空气中的氧氧化为Fe(III)是难免的,所以在实验室保存Fe2+溶液往往是在强酸性下加入铁屑或铁钉。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。
 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。
高中生看看得了,考试就当没有! 1. NaCHNO (冠醚配合物) → Na:...
氧化还原反应是中学化学重要的理论知识,在高考题中常与元素...
在氧化还原反应中,高锰酸钾在酸性溶液中能表现出强氧化性,...
我们现在还无法测定金属与盐溶液之间电极电势的绝对值,只能...
能斯特方程: 对于 任何电对 [ Ox ]/[ Red ],其电极反应 : 氧化型...
标准电极电势 φ 的应用 1. 利用标准电极电势判断氧化剂、还原...