
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
—、问题的提出
电化学理论知识是学生在高二化学学习中遇到的难点之 一,也是高考重要的考点。在实际教学过程中,演示实验里“粗锌(含少量铅、铜等不活泼杂质)和稀硫酸反应比纯锌和稀 硫酸反应制氢气速率要快很多”,这时教师就会给学生一个 结论:“粗锌中由于有杂质,杂质和锌形成了原电池,所以加快了化学反应速率。”
“为什么? ”此吋学生都往往会追问老师。
“实验现象说明。”教师回答。
“理论解释呢? ” 学生仍感好奇。
此时若不回答或敷衍着说一句“高考不考理论解释,只需记住结论就行了”,都会严重挫败学生的学习积极性。也正因为没有解释清楚它的来龙去脉,在高三复习中学生也会对这个教师重复过多遍的“重要结论”想不起来使用。
二、双电层理论
如果把金属放入其盐溶液中,则金属和其盐溶液之间产 生了电势差,此即称为金属的电极电位,它可用于衡量溶液中金属失去电f能力的大小或金属的阳离子获得电子能力的大小。1889年,德国化学家能斯特(H. W. Nernst)提出了 双电层理论,用以说明金属及其盐溶液之间电势差的形成和原电池产生电流的机理。
他认为,由于金属晶体是由金属原子、金属阳离子和自由电子所组成的,因此,若把金属置于其盐溶液中,在金属与其盐溶液的接触界而上就会发生两种不同的过程:一种是金属表面的金属阳离子,受极性水分子的吸引和本身的热运动而进入溶液的过程;另一种是溶液中位于金属表面的水合金属离子,受到自由电子的吸引,结合电子成为金属原子而重新沉积在金属表面上的过程。当这两种方向相反的过程进行的速率相等时,即达到动态平衡:
M(s) Mn+(aq)+ne-
Mn+(aq)+ne-
显然,如果金属越活泼或溶液中金属离子的浓度越小, 金属溶解的趋势就越大于溶液中金属离子沉积到金属表面上的趋势,达到平衡时金属表面就因聚集了金属溶解时留下的自由电子而带负电荷,溶液则因金属离子进入溶液而带正电荷,这样,由于正、负电荷相互吸引,在金属与其盐溶液的接触界而处就建立起由带负电荷的电子和带正电荷的金属离子所构成的双电层(图1(a))。相反,如果金属越不活泼或 溶液中金属离子浓度越大,金属溶解的趋势就越小于金属离子沉积的趋势,达到平衡时金属表面聚集了金属离子而带正电荷,而溶液则由于金属离子减少而带负电荷,这样,也构成了相应的双电层(图1(b))。这种双电层之间存在一定 的电势差,这个电势差即为金属与金属离子所组成的氧化还原电对的平衡电势。
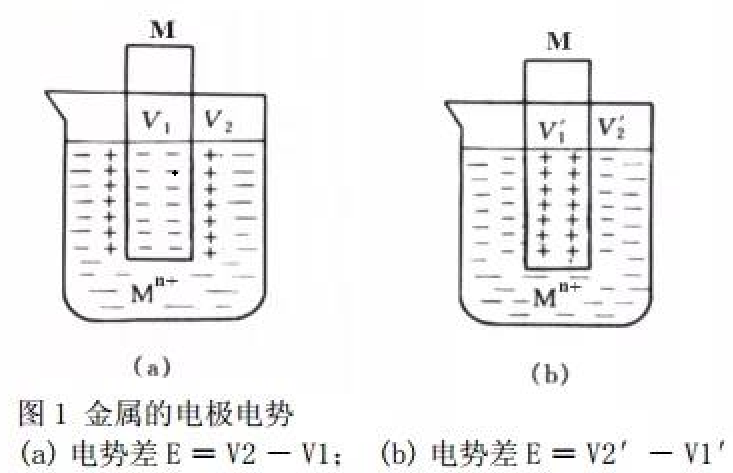
由于金属与其相应离子所组成的氧化还原电对不同,金属离子的浓度不同,这种平衡电势也就不同。因此,若将两 种不同的氧化还原电对设计构成原电池,则在两电极之间就会有一定的电势差,从而产生电流。
三、问题的解释
根据双电层理论:在锌铜(铜为杂质)原电池中,由于金属锌失去电子的趋势比铜大,因此锌片上形成了负电荷的电子和带正电荷的Zn2+所构成的双电层,而铜片上也形成了带正电荷的Cu2+和带负电荷的溶液所构成的双电层。这时锌片上有过剩的电子,铜片上则缺少电子,由于存在电势差, 电子就从锌片移向铜片。锌片上的电流出,破坏了它和溶液中Zn2+之间的平衡,锌就有可能不断地把Zn2+投向溶液;同理,铜片上电子的流入,就使溶液中的H+不断地和电子结合而放出氢气。
而纯锌和稀硫酸反应,锌片上形成了负电荷的电子和带正电荷的Zn2+所构成的双电层,溶液中的H+需要穿越带正电荷的Zn2+电层的包围才能在锌片上得到电子,同性电荷相斥。所以,溶液中的H+在铜片上得电子比在锌片上更容易,这也就说明了形成原电池可以加快化学反应速率的原理。
参考文献
[1][美】巴德(Bard A. J.),[美]福克纳(Faulkner L.R.)著,邵元华等译.电化学方法原理与应用[M】.北京: 化学工业出版社.2005.
[2]北京师范大学无机化学教研室等编.无机化学第四 版[M].北京:高等教育出版社. 2002

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。
 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。
所谓缓冲溶液,是指能维持溶液的酸度,使溶液的pH不因外加少...
...
什么是PH?PH是拉丁文“Pondushydrogenii”一词的缩写(Pondus=压强、压...
一、水的离子积计算 水的离子积( K w )是一个使用频率较高的化...
多元弱酸在水中是分步电离的,因此,计算时应考虑电离 / 反应...
强酸溶液氢离子浓度: HCl 溶液中,完全电离,因此 [H + ]=[ Cl ...