
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
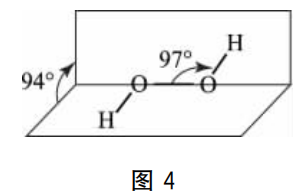
H2O2 分子具有如图4所示的“二面型”结构,其正负电荷中心不能重合,所以属于极性分子,在H2O2 分子中,因O-O键无极性,其电子对不偏向任何一方,所以氧元素的氧化数(化合价)为-1, 这个介于氧元素稳定氧化数-2和单质0价之间的氧化数,决定了H2O2 既具有氧化性,又具有还原性的双重性质特征。如:
使酸性KMnO4溶液褪色:2MnO4-+5H2O2+6H+= 2Mn2++5O2↑+8H2O(显还原性);
使酸性KI溶液显棕黄色:2I-+H2O2+2H+=I2+2H2O(显氧化性)
自身分解:2H2O2 2H2O+O2↑(同时显氧化性和还原性)
2H2O+O2↑(同时显氧化性和还原性)
从微观结构看,H2O2分子结构不稳定的原因,主要是2个电负性都很大的氧原子相互“争夺”中间的电子对,导致“内部紧张”,遇到“外力介入”则发生相应的变化,换句话说,H2O2中2个氧原子间通过共用电子对结合在一起只是“权宜之计”,一旦外界条件具备,还是要“各奔东西”。
另外,2个-OH基团连接在一起,彼此对对方具有一定吸电子诱导效应的影响,可以使对方的O-H键极性略有增强(与 H2O中的O-H键相比),故而H2O2具有微弱的酸性—比H2O稍稍容易电离出H+。
值得一提的是,很多化合物中也存在-O-O-这样的结构,称为“过氧链”,含有过氧链结构的化合物都具有和H2O2相似的化学性质—不稳定、既具有氧化性又具有还原性。如过氧乙酸CH3COOOH、过二硫酸钠Na2S2O8等,生产、生活、科学实验中常常利用这些物质的氧化性。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。
 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。
磷作为周期表第 ⅤA 族核心元素,兼具 “生命不可替代性”(构...
硫酸盐 俗名 颜色 用途 2CaSO 4 H 2 O 熟石膏 白色 CaSO 4 2H 2 O 生石膏...
...
1.在二元化合物中,如果电正性的金属元素仅出现两种氧化态时...
合金的熔点一定低于各成分金属吗?教材只是说合金的硬度、熔...
金属锌与硝酸的反应,是一个非常经典的化学反应问题。金属锌...