
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
问题1、为什么说电解质导电的过程一定发生了化学变化?给电解质通交流电时,也会发生电解反应吗?
金属导电只是电子在金属晶体内定向移动,导电前后金属材料不会发生变化,故金属导电是物理过程。
电解质导电指的是处于“金属导线—电极—电解质”闭合回路里的电解质的导电过程,并非特指电解质溶液内部(若单指这部分离子移动,就只是物理变化了)。试想,在导线和电极中运动的带电粒子是电子,而电解质中运动的带电粒子则是阴阳离子,那么在电极表面上,这两类不同的带电粒子之间是如何实现转换的呢?
通过氧化还原反应!在阳极,只能是阴离子(宏观上看也许是分子,甚至可能是具有还原性的阳离子)失去电子发生氧化,然后电子继续在电极和外电路中定向运动,接通闭合回路。在阴极,则是阳离子获得电子(宏观上也可能是分子或某些含有高价态元素的阴离子)发生还原反应,即阳离子接受外电路通过电极输送过来的电子(发生还原反应),以接通闭合回路。所以说,电解质导电的过程,一定是发生电解反应(氧化还原反应)的过程。
让交流电通过电解质,也照样发生上述氧化还原反应。只是由于交流电的电流方向是瞬时来回变换的,电极的阴阳关系不断变换,导致上个![]()
![]() s(指用50Hz的交流电)阳极的氧化产物(假设是Cl2)尚未离开电极,下个
s(指用50Hz的交流电)阳极的氧化产物(假设是Cl2)尚未离开电极,下个![]() S立刻被还原回去(Cl2得电子还原为Cl-)了.可以认为,交流电通过电解质“只有电解的过程,没有宏观的电解结果”。
S立刻被还原回去(Cl2得电子还原为Cl-)了.可以认为,交流电通过电解质“只有电解的过程,没有宏观的电解结果”。
问题 2、原电池或电解装置中,惰性电极常常用Pt或者石墨(C),Pt电极与石墨电极有何异同?
石墨和金属铂化学性质均很稳定,都是常用的电极材料.这两种电极材料的差异在于一个便宜(石墨)、一个贵(铂)。所以,石墨的使用远比金属铂普遍。
那么,为什么不都用便宜的石墨呢?因为石墨有它自身的弱点。首先它的导电性不如铂好,其次石墨材料会对某些电解质成分(或电极产物)发生吸附作用,在一些精密电化学实验测量中会导致误差。所以即使铂比较贵,有时也不得不用。
问题3、电解过程中,OH-是怎样放电变为氧气和水的?
对于H+、Cl-、Cu2+放电,我们比较容易理解:H+获得一个电子变为H原子,2个H原子结合就成为氢分子。Cl-、Cu2+两个离子的放电过程也是同理。
OH-是如何放电的,教科书上只给出了方程式,而没有解释其过程.让我们发挥微观想象力,解读如下:
放电(失去1个电子)后变为羟基(![]() ).而羟基是含单电子的微粒,极不稳定,于是2个羟基立即相互结合形成过氧化氢分子H2O2 ,过氧化氢也不稳定,会在电极表面分解(电解质电阻相对较大,故电解过程必有热量产生,可加速H2O2分解)为水和氧气(由于过氧化氢不会完全分解,故任何水溶液电解时其阳极区的溶液都有强氧化性)。即:
).而羟基是含单电子的微粒,极不稳定,于是2个羟基立即相互结合形成过氧化氢分子H2O2 ,过氧化氢也不稳定,会在电极表面分解(电解质电阻相对较大,故电解过程必有热量产生,可加速H2O2分解)为水和氧气(由于过氧化氢不会完全分解,故任何水溶液电解时其阳极区的溶液都有强氧化性)。即:
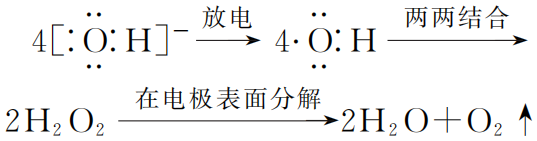
总反应 :4OH--4e-=2H2O+O2 ↑.
与OH-放电产生—OH道理相似,对于O2在原电池正极上放电过程可做如下理解:

总反应:O2+4e-+2H2O=4OH-.
问题4、在水溶液里,为什么活泼金属阳离子和含氧酸根离子不放电?它们真不放电的话,电解水时加硫酸钠还能增强导电性、加快电解过程吗?电解熔融Na2SO4 时,SO42-将如何反应?
这是一个颇有价值的问题,让我们先以惰性电极电解硫酸钠溶液解析如下:电解过程中,钠离子等活泼金属离子向阴极移动,既然溶液里的钠离子都向阴极移动,当它们把整个阴极覆盖后,若它们还不放电,岂不是要使电解过程终止吗?
显然,钠离子是要获得电子成为钠原子的,不过,由于钠原子极其活泼,一旦形成便立即与水作用重新形成钠离子,这样宏观上看,Na+没有变化。
有一个事实可以佐证Na+会在阴极放电.这就是氯碱工业早期使用的“汞阴极法电解食盐水”工艺过程,如图1所示.
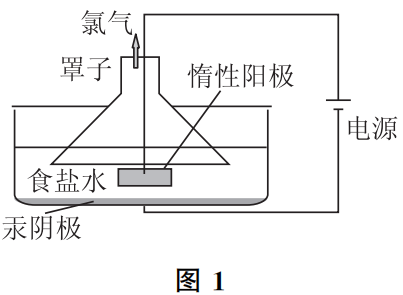
此电解过程中,电解池中只有Cl2逸出,并不能获得H2与烧碱溶液,电解一段时间后,将阴极的“汞(溶有钠)”抽出注入热水中,才可收集到H2,同时获得烧碱溶液.这是因为,在电解池里,Na+获得了电子还原为单质Na,而单质Na迅速溶于阴极的汞中,避免了被食盐水中的H2O氧化回Na+.
同理,硫酸根等含氧酸根离子也会放电.简析如下:
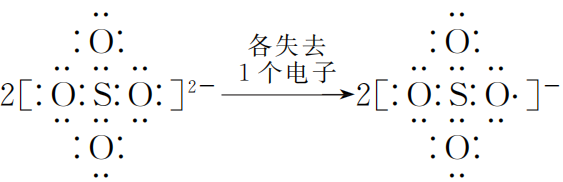 (1个氧原子有单电子,不稳定)
(1个氧原子有单电子,不稳定) ![]()

(过二硫酸根离子,含有过氧链,不稳定) ![]() H2O2+2SO42- +2H+
H2O2+2SO42- +2H+![]() H2O+1/2O2↑+2SO42-+2H+
H2O+1/2O2↑+2SO42-+2H+
这样最终还是表现为水电离出的OH-放电形成水和氧气.上述过程是客观存在的,工业上可根据上述原理制备过氧硫酸(盐)或过氧化氢(H2O2 ).
基于以上分析可知,电解熔融的Na2SO4时,阴极应该得到Na,而阳极SO42- 失去电子则可能得到SO3、SO2、O2 等,之所以考虑到可能产生SO2 ,因为盛有熔融Na2SO4的电解槽一定是高温状态,SO3有可能发生部分分解反应。
问题5、为什么Zn2+、Fe2+、Sn2+等在水溶液里会放电,而K+、Ca2+、Na+、Mg2+、Al3+却不行?
理论上,任何阳离子都有可能在阴极获得电子被还原.如前面分析,K、Ca、Na、Mg、Al这些极其活泼的金属,在水溶液里即使还原出来,也会立即被H2O氧化回离子状态.故我们讲“宏观上K+、Ca2+、Na+、Mg2+、Al3+不放电”.显然,从事实来看,在酸性不强的水溶液中,Zn、Fe、Sn等金属不易被H2O氧化,当其对应离子浓度较大时,它们可以在阴极获得电子被还原出来。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。
 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。
锌溴液流电池是一种大规模储能电池,相比传统铅酸电池锂离子...
【解析】: A.电解氧化的目的是在铝制品表面形成氧化膜,所以代...
并非所有放热反应都可以设计为原电池。能否设计为原电池的关...
空穴在半导体和绝缘体中扮演着重要角色,在化学中空穴缺电子...
一、天然冰晶石(NaAlF)的发现:18世纪的格陵兰矿物探索 天然...
【导读】“正/负”看电势,按照电势高低,高正低负,绝不互换...