
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
一、 氧化还原反应方程式的书写
【模型口诀】
失升氧化还原剂,七字口诀要牢记,先定两剂与两物,再平电子和原子。
【模型思考】
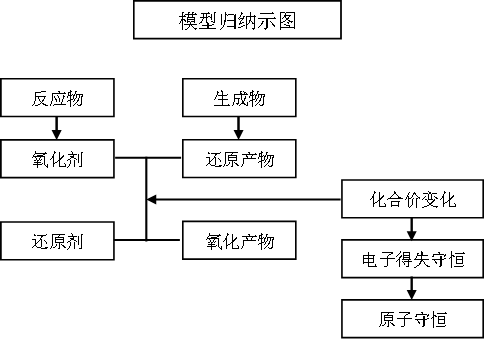
1.解读氧化还原反应方程式时,先判断变价元素,然后按照“失(电子)、升(价)、氧化(反应)、还原剂”进行分析。
2.书写氧化还原反应方程式时,
第一步:先确定反应物中氧化剂、还原剂;生成物中的氧化产物和还原产物。
第二步:利用电子守恒进行配平。配平时的逻辑关系不能忽略,先要电子得失守恒,然后原子守恒。若先原子守恒配平,必须验证电子是否守恒。
如果是氧化还原形的离子方程式则应遵循:电子守恒、电荷守恒、原子守恒的逻辑关系。
二、离子方程式正误的判断
【模型口诀】
牢记“三死一灵活”,判断正误不迷惑,写、拆、删、查四步曲,正确书写不出错。
【模型思考】
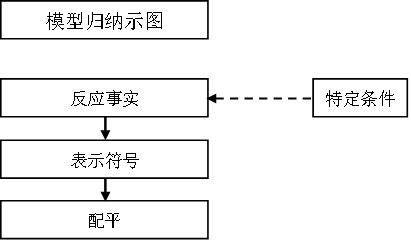
1.判定离子方程式是否正确的方法按照“三死一灵活”的顺序判断,“三死”是指(1)“拆”得对否;(2)电荷、质量守恒;(3)盐类水解符号的使用和分步是否正确。“一灵活”是指反应是否符合客观实事。
2.书写离子方程式时,可按“写、拆、删、查”四步进行。
3.解读是上述的逆向思维,要理解离子符号代表哪类电解质,才能确定该离子方程式代表哪类物质间的反应。
三、化学方程式的书写
【模型口诀】
吸放热、对正负,标状态、定系数,按照目标变换式,盖斯定律大用处。
【模型思考】
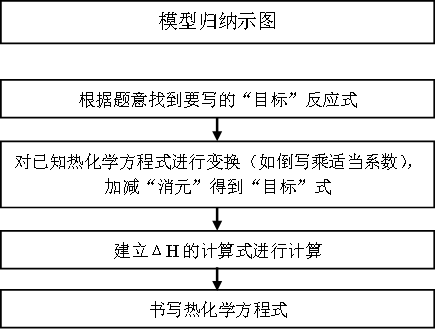
有些反应的反应热不易测得,通过已知反应的反应热,利用盖斯定律获得:
第一步:要确定需要的反应的反应热,其中的反应物和生成物的状态和化学计量数关系。
第二步:将已知的热化学方程式按照所要获得的反应,进行变换,对不需要的物质进行定量的“消元”——都是反应物(或都是生成物),可做减法;一项是反应物,一项是生成物,可做加法,同时可用相同的数学式计算出该反应的ΔH,最后书写出热化学方程式。
四、化学平衡移动
【模型口诀】
审清特点与条件,再用勒夏原理判。平衡程度比大小,建立模型解决它。
【模型思考】
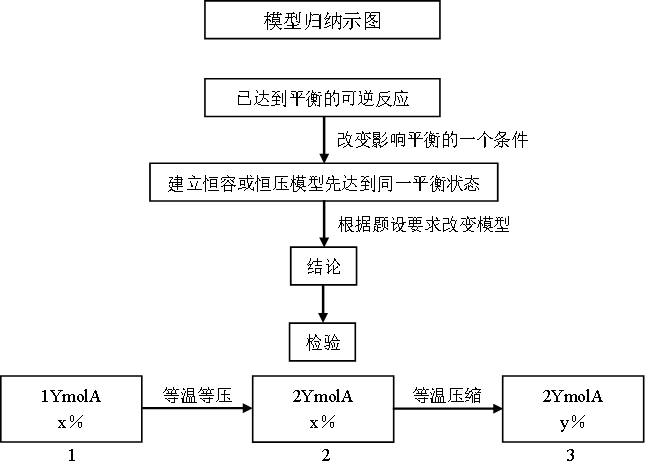
化学平衡研究的是密闭体系中的可逆反应,当可逆反应达到化学平衡状态时,遇到平衡移动问题,我们解题的步骤和方法是:
第一步:关注已达平衡的可逆反应特点。
第二步:关注提干条件,是恒温恒容还是恒温恒压。
第三步:如果改变影响平衡的一个因素,我们可以根据平衡移动原理,即勒夏特列原理分析平衡移动的方向。
但有些题目不仅仅需要我们判断平衡移动的方向,还通常在判断平衡移动方向后让我们比较前后两次平衡的关系,碰到这种问题我们经常洗建立一个与平衡“等效”的模型,再根据题目中的要求通过改变模型分析平衡移动的方向和结果。
当然,分析化学平衡问题时应该注意平衡的建立与途径没有关系,研究平衡问题时注意矛盾的主次,应用守恒的思想和极限的思想解答问题。
五、物质结构和元素周期律
【模型口诀】
脑里有张周期表,心中牢记周期律,位构性一体,知一求其余。
【模型思考】
利用元素在周期表中的位置、物质的结构和性质这三者之间的关系,即:
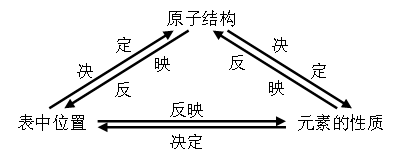
从这个三角关系中的一点突破,注意挖掘和应用元素周期表中隐含的重要知识和小规律,是解答物质推断题的主要线索和方法。如果是从元素周期表开始设问的题目,解题的关键是必须熟悉周期表的结构,头脑中必须有一张清晰的元素周期表,根据题目中所给信息“摆”元素的相对位置,进而根据元素周期律进行推断。如果是从结构开始设问的题目,解题的关键是必须抓住物质的结构特征,进而推断物质的性质在周期表中的位置。
六、电化学
【模型口诀】
三个口诀两规律,轻松学通电化学;
口诀1:阳负升失氧化,阴正降得还原。
口诀2:电解异性相吸,原电池同性相恋。
口诀3:电子固定负极流出,正极流入。
规律1:阳极或负极是活性金属时,金属一定会参加反应;阴极或正极是活性金属,金属一定不会参与反应。
规律2:氧气参与反应时,通入氧气的电极一定是正极。
【模型思考】
1.口诀1:即阳极或负极的反应物化合价升高,失去电子,被氧化,发生氧化反应,阴极或正极相反。
2.口诀2:即发生电解反应时,阳离子移向阴极,阴离子移向阳极;发生原电池反应时,阳离子带正电荷移向正极,阴离子带负电荷移向负极。
3.口诀3:即无论原电池反应还是电解反应,电子总是从电源的负极流出,流入电源的正极。
4.解电化学问题,先判断是原电池还是电解池,再根据“三口诀两规律”思考。

七、比较溶液中粒子浓度关系
【模型口诀】
溶液粒子比大小,反应先行看构造;
盐在溶液先电离,主次矛盾不混淆;
物料电荷均守恒,定性定量把握好。
【模型思考】
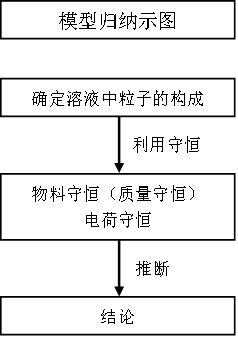
比较溶液中粒子浓度大小关系的问题:
第一步,应先确定溶液中粒子的成分,溶液中物质间若能发生化学反应,则优先考虑化学反应;
第二步,反应后首先从守恒出发,根据溶液中存在的物料守恒(质量守恒)或电荷守恒进行分析比较,根据守恒初步得到结论,所谓物料守恒就是某一组分的原始浓度应该等于它在溶液中各种存在形式的浓度之和,所谓电荷守恒就是溶液中的阳、阴离子的正负电荷总数相等。
分析问题要注意盐在溶液中以电离为主,多元弱酸溶液,以第一步电离为主,每一步电离一次减弱。如果还不能比较大小,最后再考虑水解平衡或电解质的电离平衡。解答水溶液中的问题,要善于通过题目中所给的信息分析在溶液中存在的平衡,对于存在多种矛盾时要抓住问题的主要矛盾,利用平衡移动原理和守恒关系推断结论。
八、从结构角度进行物质推断
【模型口诀】
物质推断题,结构要清晰;
位构性一体,心中要牢记;
表中多元素,运用周期律;
摆出相对位,轻松就破题。
【模型思考】
利用元素在周期表中的位置、物质的结构和性质这三者之间的关系,即:
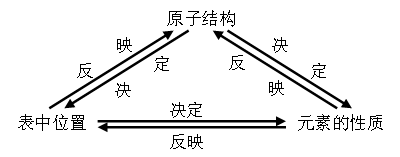
从结构角度进行物质推断的解题关键是:依据物质特征结构,即原子结构、分子结构或晶体结构来确定解答物质推断题的主要线索和方法,再根据位、构、性之间的关系,注意挖掘和应用元素周期表中隐含的重要知识和小规律,并以此为“突破口”完成全部未知物的推断。
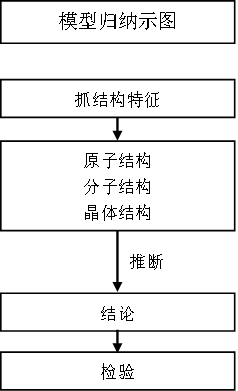
九、元素及其化合物综合推断
【模型口诀】
心平气和要沉着,仔细审题寻突破,分析推断得结论,回过头来验对错。
【模型思考】
这是一类经典试题,综合度较高,题目常见呈现形式有框图、流程图、结合实验的文字叙述、表格等。其问题设计的核心是“元素→物质→反应”,即以核心元素为载体考查其原子结构、元素在周期表中的位置、元素的性质等知识;进而考查简单物质结构和物质间的化学反应规律和化学反应原理,以及实验、计算等相关知识。
1.推断元素时,试题主要在短周期元素范围内考查,短周期中常见的非金属元素以原子序数从小到大排列为氢(H)、碳(C)、氮(N)、氧(O)、硅(Si)、硫(S)、氯(Cl)等,短周期中常见的金属元素有钠(Na)、铝(Al)等,结合相应的“位、构、性”信息进行推断。进而回答与元素有关的问题,常见的问题有元素名称或符号、原子结构示意图、元素在周期表中的位置、元素周期律等。
2.推断物质时,结合元素和物质结构信息,如化学键类型、物质类型等,以及物质性质及转化等进行推断。进而回答①与物质有关的问题,常见的问题有物质种类、化学键类型、物质的电子式等。②与反应有关的问题,常见的问题有化学反应类型、物质相关转化的化学方程式或离子方程式、根据信息书写陌生反应的化学或离子方程式、化学实验、化学定量问题等,以及化学反应原理的有关问题,例如书写热化学方程式、水溶液中离子平衡、化学反应速率和化学平衡的问题等。
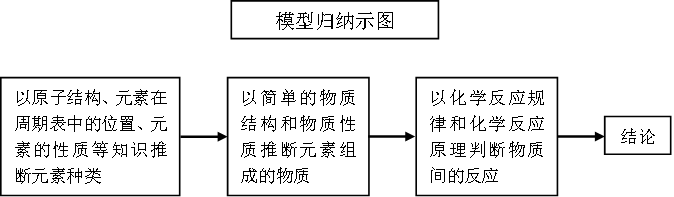
十、工业生产和流程综合推断
【模型口诀】
工业生产流程题,先看原料和目的;
最终产物很重要,对应工艺找信息;
生产过程就两类,分离转化交融起;
解决问题用基础,完成生产看能力。
【模型思考】
以工业生产为载体的试题是紧密联系实际,是考查分析解决实际问题能力的题目,对提取和分析信息合理分类,并结合已有知识解答问题的能力要求较高,试题的信息量大、综合度高,是目前高考中的常见题型。其最核心的问题是“物质的转化”与“物质的分离”,在物质转化中考查化学反应规律和化学反应原理。呈现方式多为流程图或文字表述。常涉及的问题有:
①物质间转化,例如应用复分解反应规律或氧化还原反应规律书写物质转化反应的化学方程式或离子方程式,常会涉及一些陌生反应的书写。
②物质与能量的转化,即化学能与热能、化学能与电能的转化,例如应用盖斯定律书写反应的热化学方程式,应用氧化还原反应原理书写原电池或电解池的总反应方程式或电极反应式等。
③对物质转化的控制,通过控制转化的反应条件提高物质的产率及节能环保等,应用化学反应原理知识解释一些问题,例如应用化学反应速率和化学平衡(包括水溶液中的离子平衡)原理解释等。
④物质的分离方法,例如混合物的分离方法及操作等实验问题。
⑤通常也会涉及定量问题,例如产品的产量、产率、纯度等。
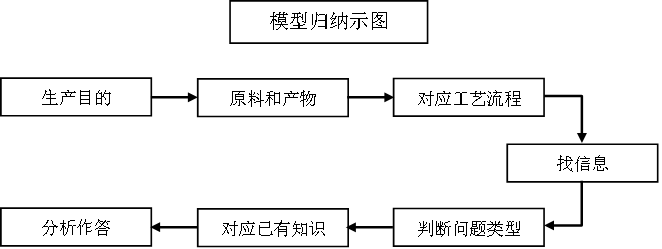
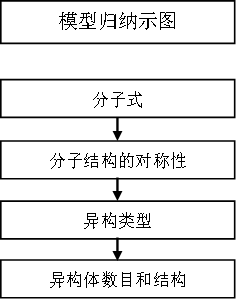
十一、同分异构体判断
【模型口诀】
分子式、定结构,分析结构找对称,
类别异构先确定,碳链异构二分清,
三看官能团异构,有序思维方法优。
【模型思考】
第一步:知道了有机物分子式,确定或预测有机物类别和官能团种类;
第二步:根据有机分子结构,确定分子结构的对称性;
第三步:根据限制条件收敛,确定同分异构的可能类型;
第四步:通过有序思维判断同分异构体数目,并书写其结构。
十二、有机化合物推断
【模型口诀】
有机推断,突破当先,
捕获信息,解惑谜团。
碳数碳架官能团,落实它们最关键,
正推逆推相结合,掌握方法好推断。
【模型思考】
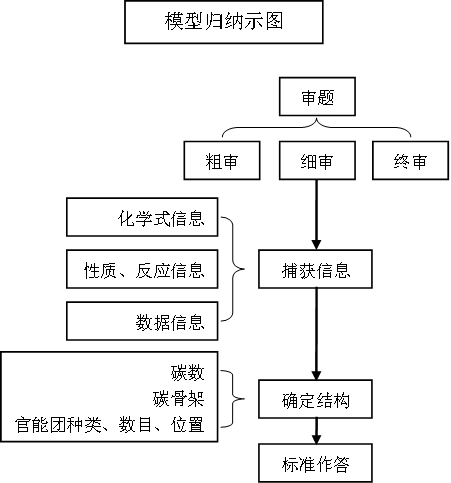
审题中一审为浏览;二审需要捕获有效信息进行突破。所推出的有机物结构完全符合题中的各项信息——即终审,再落笔作答。
其中“细审→捕获信息→锁定结构”是解题思维模型的主要部分:
①由分子式信息可获得组成元素、不饱和度,预测可能结构和官能团。
②由性质、反应等信息可获得官能团种类;由数据信息可获得官能团的个数;由同分异构体信息可得到官能团位置等。
③由其他信息可以了解碳骨架等。
落实三要素:碳数,碳骨架,官能团种类、数目、位置,从而确定有机物结构。
推断过程中可采取“正推”“逆推”或两者结合的方法“加加减减”的残基法,将解决问题最小化,最后要将多方面多角度摄取得信息进行整合、分析、归纳,最后推断出有机物结构。
十三、物质(或离子)检验
【模型思考】
物质检验并不难,常用方法须熟练,重点关注四方面,表述力求准简全。
【模型思考】
物质检验是实验试题或综合试题中常见的问题,物质检验的核心是基于物质性质确定检验方法,分为定性检验和定量检验。常见的试题类型有:
①检验单一物质或离子;
②检验混合物中的某种物质或离子;
③判断离子是否共存;
④具体问题情境中的物质检验,例如洗涤过程中,通过检验物质或离子确定是否洗涤干净;
⑤物质成分的定量检验等。
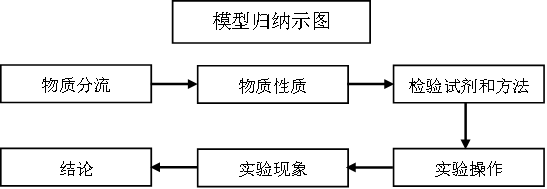
解答试题时,应依据物质检验的解题模型即“物质分类←→物质性质←→检验试剂和方法←→实验操作→实验现象→结论”进行分析,例如:检验NH3,NH3是碱性气体,应利用其碱性进行检验,所以,可用湿润的红色石蕊试纸变蓝;或利用铵盐的性质,遇蘸有浓盐酸的玻璃棒生成白烟进行检验。每个试题的考查角度会有所不同,例如有些试题仅考查检验方法,有些则重点考查基于检验方法的实验操作等。
检验离子时应注意的问题不能单独存在,而是存在于物质中。例如:检验NH4+,NH4+存在于铵盐中,应利用铵盐的性质检验,即铵盐与碱反应生成氨气,再检验氨气。
十四、混合物分离
【模型口诀】
除杂方法常有六,加热、降温水吸收。
化学方法通常用,萃取分离或蒸馏。
【模型思考】
混合物分离也是实验试题或综合试题常见的问题,往往通过物质转化进行分离,物质分离的核心是物质性质和实验方法,目的是获取纯物质,所以,在物质转化过程中,需关注是否会引入新杂质,以及混合物中物质相互干扰的问题。常见的问题有:
①选择适当的分离方法;
②选择适当的试剂。
十五、实验设计
【模型口诀】
找准实验目的,明确实验原理,
设计实验方案,规范表述答案。
【模型思考】
综合实验试题往往是一份试卷中综合度较大的试题,实验是重要的研究方法,以某些知识为载体研究物质的性质、进行物质制备、研究反应原理等,既有定性实验,也有定量实验。更重要的是,综合实验还承担考查实验研究方法的功能。所有,实验综合试题知识的综合度较高、分析和解决问题能力的能力要求高,既考查实验本身的内容,还考查一些知识的内容和研究方法。中学化学实验设计的一般类型:①物质的制备实验方案的设计;②物质的性质实验方案的设计;③物质的分离、提纯、检验实验方案的设计;④定性实验,例如制备、鉴别、鉴定、性质的比较、分离、提纯等;⑤定量实验,例如化学式、结构的推断,结晶水数目的测定,纯度、浓度、溶解度的测算和中和滴定等。
问题涉及:
(1)实验研究过程:例如实验目的、反应原理、装置原理、操作原理等;
(2)实验研究方法:例如实验探究、控制变量等;
(3)实验基本技能:例如表述实验操作、实验现象等;
(4)实验方案设计或评价:例如依据实验目的设计实验步骤或评价、解释已有方案等。
十六、阿伏加德罗常数的判断
【模型思考】
确定粒子来源,宏观连接微观,
定量关系准确,简单公式运算。
【模型思考】
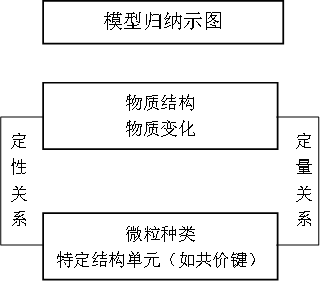
首先要从宏观角度了解微观粒子、特定结构单元(如共价键)的来源:物质状态、物质结构、物质组成、化学反应、电解质溶液等,建立宏观物质和微观粒子的定性关系;其次再建立宏观物理量和微观物理量的定量关系,联系的桥梁即NA,1NA即1mol。
十七、利用化学方程式的计算
【模型口诀】
化学式子要配平,换算纯量代方程;
左右单位要相应,上下单位须相同;
遇到两个已知量,应找不足来进行;
遇到多步反应时,关系式法有捷径。
【模型思考】
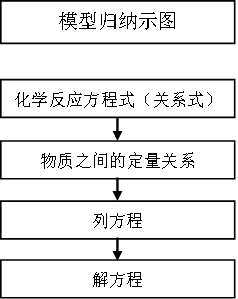
先写出试题中有关反应的化学方程式或关系式,然后建立已知与未知纯物质的定量关系,也可以是反应过程的非气态物质质量变化量(△m)或气体体积变化量(△V),按比例列方程,最后解方程。
1.必须掌握常见的化学反应方程式,且书写正确。
2读懂题意:
(1)有关反应;
(2)已知条件(哪一物质,什么物理量);
(3)未知-求什么(哪一物质,什么物理量)。
3选择恰当的物理量对准关系式:
同一物质应为相同物理量,且单位相同;
不同物质可为不同的物理量,但单位要匹配。
十八、守恒法的应用
【模型口诀】
反应过程,原子守恒:
氧化还原,电子守恒;
离子反应,电荷守恒;
确定守恒,布列方程;
应用守恒,解题速成。
【模型思考】
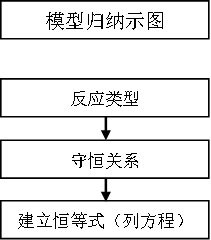
应用时首先要确定所需要解决问题的反应类型,判断可以应用哪种类型的恒等关系来解决问题,最后建立相关的恒等式进行计算。在化学反应中,经常应应的恒等式有:
(1)质量守恒:参加反应的各物质质量总和=生成的各物质质量总和,应用于一步化学反应中。
(2)原子守恒:反应前后原子种类和数目不变,应用于一步或多步化学反应、离子反应中。
(3)电子守恒:得电子总数=失电子总数,应用于氧化还原反应。
(4)电荷守恒:所有阳离子所带的正电荷总数=所有阴离所带的负电荷总数,应用于离子反应或电解质溶液中。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。
 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。
以大学教师为主的命题组在命题时,常会因学术背景的惯性而“...
碳酸氢钠是个“小白脸”(白色细小的晶体), 它很容易“生气”...
高考化学知识非常庞杂,有哪些方法技巧可以遵循?本文整理化...
高考是一场无声的战争,要想漂亮地赢得这场战争的胜利,不仅...
问1:考前五分钟如何利用? 答1:考前五分钟试卷就发到你手中...
选择题 大家都知道高考化学选择题分值很高(一般是六分),所以...