
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
在溶液体系中,压强很难改变体系体积,所以不分析压强对体系的影响,一般只分析温度和浓度对平衡的影响。
若在溶液中加某物质,分析体系的变化时,要分两种情况。要么这种物质是纯净物或浓溶液且量很少,只考虑造成浓度增加,不造成体系体积变化。要么是稀溶液,考虑造成体系体积的变化,计算浓度的变化,判断造成的结果。在分析平衡的移动时,一般都默认为第一种情况。
水溶液中的平衡常数表达式在书写时要注意,用离子方程式来书写才是对的。比如,在FeCl3+3KSCN⇌Fe(SCN)3+3KCl平衡体系中,平衡常数的表达式为K=c[Fe(SCN)3]/c(Fe3+)·c3(SCN-)。若写为K=c[Fe(SCN)3]·c3(KCl)/c(FeCl3)·c3(KSCN)则是错误的。
这一讲包括弱电解质的电离平衡,水的电离平衡,一些盐的水解平衡,难溶电解质的溶解平衡。
1、弱电解质的电离平衡
(1)化合物按在水中的电离能力分类

其中弱电解质在水中形成电离平衡。如CH3COOH水溶液中,存在电离平衡CH3COOH⇌CH3COO-+H+。
(2)CH3COOH电离平衡的平衡常数与平衡移动
CH3COOH⇌CH3COO-+H+
①多数弱电解质的电离是吸热的。所以升高温度时,电离常数变大。电离平衡正向移动。
电离常数表达式为Ka= c(H+)·c (CH3COO-)/·c(CH3COOH)
Ka表示弱酸的电离平衡常数,Kb表示弱碱的电离平衡常数。
比较酸碱性强弱时,常常比较电离平衡常数。
②CH3COOH溶液中再加纯CH3COOH时平衡正向移动,但电离程度是减小的。(类似于等效平衡中的充气问题)
③稀释时,平衡正向移动,电离程度是变大的。(类似于气体体系的减小压强,扩大体积)
④稀释时,CH3COO-、H+的浓度先变大,后变小:因为纯CH3COOH中没有电离,只有分子。
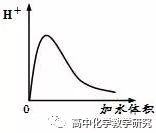
⑤CH3COOH溶液中加浓CH3COONa、浓盐酸,平衡逆向移动。
⑥CH3COOH溶液中加NaOH,H+被消耗,平衡正向移动。
(3)多元弱酸存在分步电离。
例如,H2S的水溶液,存在着弱酸的两次电离:
H2S⇌HS-+H+,HS-⇌S2-+H+
二次电离的平衡常数表达式分别是
Ka1= c(H+)·c (HS-)/·c(H2S),Ka2=c(H+)·c (S2-)/·c (HS-)
Ka1>>Ka2,第一次电离的酸性远大于第二次电离的。书写二元弱酸的电离方程式时,通常只写第一步。
①当H2S和HS-共存于同一溶液时,H2S先发生中和反应。(酸性强的先反应)
这就是在过量问题的分析中,为什么在H2S溶液中滴入NaOH时,会先和溶液中的H2S反应,然后再和NaHS反应。在和H2S反应的过程中,NaHS一直处于等待状态。
②更难的一个问题是,若某一种弱酸的酸性正好介于另一种二元弱酸的两次电离的酸性之间,则更复杂。
例如:HClO的电离常数Ka=3×10-8,H2CO3的电离常数为Ka1=4.31×10-7,Ka2=5.61×10-11。问NaClO溶液中通入少量的CO2与通入过量的CO2,化学方程式写法是否不同?
分析得:酸性H2CO3> HClO> HCO3-。
H2CO3的酸性是指H2CO3变为HCO3-的酸性,参考Ka1。
HCO3-的酸性是指HCO3-变为CO32-的酸性,参考Ka2。
根据强一点的酸能制弱一点的酸:
H2CO3+ClO-=HCO3-+HClO是正确的。
HCO3-+ClO-=CO32-+ HClO是错误的。
所以不管CO2少量还是过量,都只能生成NaHCO3。化学方程式的写法都为H2O+CO2+NaClO=NaHCO3+HClO。
③不只是弱电解质,酸式盐等,也存在电离平衡。
例如:NaHCO3溶液中,存在着HCO3-⇌CO32-+H+。
(4)在多数弱电解质水溶液体系中,溶质主要以分子的形式存在。
①通过计算得,常温下1mol/L 的CH3COOH溶液中,电离程度只有0.4%左右。所以在书写醋酸溶液的离子反应时,醋酸要写分子形式CH3COOH。
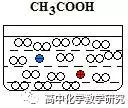
②等c(H+)的醋酸和盐酸溶液,两者的浓度差别非常大。
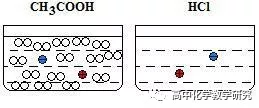
等体积与过量的Zn反应,醋酸生成的H2远大于盐酸生成的H2。
③醋酸的c(H+)与NaOH的c(OH-)相等的溶液等体积混合反应,
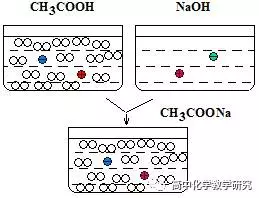
反应结果是:生成微量CH3COONa和剩余大量的CH3COOH组成的混合溶液。溶液显酸性,c(CH3COOH)>>c(CH3COO-)> c(Na+)。
2、水的电离平衡
从学了水的电离之后,任何水溶液,在考虑离子种类时,都要加上H+、OH-。任何水溶液,在考虑平衡种类时,都要加上水的电离平衡。
(1)水的电离平衡
H2O⇌H++OH-
①平衡常数:因为H2O是溶剂,在稀溶液中c(H2O)是定值,所以C(H2O)与水的电离平衡常数一起形成定值。这个定值叫水的离子积常数Kw。
Kw= c(H+)·c(OH-)
②水的电离是吸热的。升高温度,Kw变大。水的电离正向移动。
③在常温下,Kw=1×10-14
④加酸或加碱,水的电离逆向移动,水的电离程度减小。
⑤加能水解的盐,水的电离正向移动,水的电离程度变大。(见盐的水解部分)
(2)溶液的酸碱性
c(H+)>c(OH-)时,溶液显酸性,反之显碱性,相等显中性。
pH=7时,若在常温下,溶液显中性。否则,不一定,需要思考。
(3)pH值的计算
pH=-c(H+)
①若常温下c(H+)=a×10-bmol/L,则pH为b-lga。
若常温下c(OH-)=a×10-bmol/L,则pH为14-b+lga。
上面的规律需要自己通过计算获得,然后再记住。
②一种比较难的关于pH的计算题
常温下0.003mol/L 的H2SO4与0.008mol/L 的NaOH等体积混合,求pH。(先反应计算,再pH计算)
解:设NaOH溶液的体积为VL
n(H+)=0.003mol/L×2×VL=0.006Vmol
n(OH-)=0.008mol/L×VL=0.008Vmol
反应后剩余OH-,n(OH-)=0.002Vmol
反应后溶液的总体积为2VL
c(OH-)= 0.002Vmol/2VL=0.001mol/L=1×10-3mol/L
pH=14-3=11

(4)注意几种指示剂的变色范围和pH试纸的使用要求
①甲基橙的变色范围是3.1-4.4:pH<3.1时红色,pH>4.4时黄色,pH在3.1-4.4时橙色。
石蕊的变色范围是5.0-8.0:pH<5.0时红色,pH>8.0时蓝色,pH在5.0-8.0时紫色。
酚酞的变色范围是8.2-10.0:pH<8.2时无色,pH>10.0时红色,pH在8.2-10.0时浅红色。
中和滴定中,强酸与弱碱反应时,指示剂用甲基橙。强碱与弱酸反应时,用酚酞。强酸与强碱反应时,三种都可以用。(思考一下,和生成的盐的水解有关)
②pH试纸的使用与别的试纸不同。
别的试纸在检测气体时,都是先润湿,再靠近气体。
pH试纸检测水溶液时,不能润湿,只能用玻璃棒将溶液点在干燥的pH试纸上,然后与标准比色卡对照。
3、一些盐的水解平衡
(1)如何理解盐的水解
盐的水解的第一个原因是任何溶液中都存在水的电离平衡H2O⇌H++OH-。盐的水解的第二个原因是如果盐中含有弱电解质离子,弱电解质离子碰到水电离出的H+或OH-会形成弱电解质电离的逆向平衡。要想理解盐的水解,就需要先后分析这两个过程,这也是理解盐的水解的方法。
这也是只有弱酸或弱碱的盐才会水解的原因。强酸强碱盐是不会水解的。
盐的水解的方程式,实际是就是两个方程式的加和,一个是水的电离方程式,一个是弱电解质的电离方程式的逆向方程式。
例如NaCl不会水解,CH3COONa会水解。分析CH3COONa的水解原因:
H2O⇌H++OH-,H++CH3COO-⇌CH3COOH
加和得:CH3COO-+H2O⇌CH3COOH+OH-
(2)CH3COONa的水解常数与平衡移动
CH3COO-+H2O⇌CH3COOH+OH-
①水解平衡常数:H2O是溶剂,在水解过程中是常数,与化学平衡常数一起形成新常数。
Kh= c(CH3COOH)·c(OH-)/c(CH3COO-)(Kh叫盐的水解常数)
又因为盐的水解实际是水的电离平衡和醋酸电离平衡的逆向的加和。所以,Kh= Kw/Ka。通过计算也可以得到。
②盐的水解多数是吸热的。升高温度,Kh变大。盐的水解平衡正向移动。
③加CH3COONa,水解平衡正向移动,盐的水解程度也变小。(相当于充气问题)
④稀释,平衡正向移动,水解程度变大。(类似于气体体系减小压强,扩大体积)
⑤加NaOH或CH3COOH,水解平衡逆向移动,盐的水解程度变小。
⑥加盐酸,会直接与CH3COO-反应生成CH3COOH,不能说促进盐的水解。
(3)多元弱酸的正盐存在分步水解。
以Na2S为例
S2-+H2O⇌HS-+OH-
HS-+H2O⇌H2S+OH-
因为Ka1>>Ka2,Kh=Kw/Ka,所以Kh1>>Kh2。
一级水解远大于二级水解,书写正盐的水解方程式时,通常只写第一步。
当S2-和HS-共存于同一溶液时,向其中加H+时,S2-先发生反应。
这就是在过量问题的分析中,为什么在Na2S溶液中滴入盐酸时,盐酸会一直先和溶液中的Na2S反应,然后才和NaHS反应。在和Na2S反应的过程中,NaHS一直处于等待状态。
(4)多元弱酸的酸式盐既存在水解平衡,又存在电离平衡。
像NaHS溶液中,既存在水解平衡HS-+H2O⇌H2S+OH-,又存在电离平衡HS-+H2O⇌S2-+ H+。
溶液显酸性还是碱性,要看水解和电离哪个程度更大。NaHCO3溶液显碱性,NaHSO3溶液显酸性。
(5)越弱越水解。
弱电解质中酸性越差或碱性越差的,电离程度越差,逆向结合H+或OH-能力就越强,水解能力就越强。
等浓度的NaClO、CH3COONa溶液中,CH3COO-的浓度大。原因是HClO比CH3COOH的酸性差,NaClO的水解能力就强,剩余的ClO-就少。
(6)水解反应和双水解反应:
很多盐在形成水解平衡时,水解程度一般很弱,产物浓度很低,产物Fe(OH)3、H2S、H2CO3等一般不沉淀,不生成气体,不分解。
但当水解程度非常大,水解产物因为挥发或沉淀离开了溶液,水解平衡就会变成不可逆的水解反应。
FeCl3+3H2O=Δ=Fe(OH)3(胶体)+3HCl
Mg3N2+6H2O=3Mg(OH)2+2NH3↑
水解显酸性的盐溶液和水解显碱性的盐溶液混合在一起时,也容易发生水解反应,这种反应叫双水解反应。
2AlCl3+3Na2S+6H2O=2Al(OH)3↓+3H2S↑+6NaCl
但双水解反应的发生,需要盐对应的酸和碱都很弱,且水解产物都易生成沉淀或气体。
(7)水解的应用
①用热的纯碱洗涤油污,利用了纯碱水解显碱性和加热促进水解,碱性可以促进油脂的溶解。
配制易水解的盐,如FeCl3时,为防止水解产生浑浊现象,先加一些盐酸。
用氯化铵除去金属表面的锈迹,利用了氯化铵水解显酸性。
②铝盐、铁盐能做净水剂,是因为水解生成氢氧化物胶体。
③用TiCl4制备TiO2,利用了TiCl4易水解。
TiCl4+(x+2)H2O=TiO2·xH2O↓+4HCl
(8)溶液中的粒子比例变化问题
以CH3COONa溶液加水稀释为例
①最简单的是一个数值变大,一个数值变小,如c(CH3COO-)/c(H+):
c(CH3COO-)的正向继续水解和稀释使c(CH3COO-)变小。稀释会使溶液碱性的减弱,c(OH-)变小,c(H+)变大。所以c(CH3COO-)/c(H+)变小。
②两个数值都变小,但利用平衡的移动可以找到结论的,如c(CH3COO-)/ c(CH3COOH)或c(CH3COO-)/c(OH-):
稀释会使c(CH3COO-)、c(CH3COOH)、c(OH-)都变小,但平衡正向移动,会使c(CH3COO-)减小更快,所以c(CH3COO-)/ c(CH3COOH)或c(CH3COO-)/c(OH-)都变小。
③还可以利用极限法找到结论的,如c(CH3COO-)/c(OH-):
不断稀释时,c(CH3COO-)趋向于无限小,而c(OH-)趋向于1×10-7mol/L,所以c(CH3COO-)/c(OH-)变小。
④较难的应该是像这一种,[c(CH3COO-) ·c(H+)]/c(OH-):
可以通过在分子和分母同时乘以一些数据,转化为平衡常数表达式。
c(CH3COO-) ·c(H+)/c(OH-)
= c(CH3COO-) ·c(H+)·C(CH3COOH)/c(OH-) ·c(CH3COOH)
=Ka ·c(CH3COOH)/c(OH-)
Ka是常数,c(CH3COOH)/c(OH-)在变小(极限法),所以[c(CH3COO-)·c(H+)]/c(OH-)在变小。
4、难溶电解质的溶解平衡。
(1)溶解平衡
以AgCl为例
AgCl(s)⇌Ag+(aq)+Cl-(aq)
①溶解平衡常数表达式Ksp=c(Ag+)·c(Cl-)。(Ksp,溶度积常数,简称为溶度积)
②多数溶解是吸热的。升高温度,Ksp变大,溶解度变大。Ca(OH)2例外。
③加AgNO3或NaCl,平衡逆向移动,溶解度减小。
④加AgCl,平衡不移动。
⑤稀释,平衡正向移动,溶解度不变。
⑥加NaBr、KI或Na2S,平衡正向移动,溶解度变大。(沉淀的转化)
(2)溶度积与溶解度的换算
以AgCl为例:
常温下Ksp(AgCl)=1.8×10-10
解得溶解的AgCl的浓度为1.34×10-5mol/L
1L 水(1000g)中溶解了AgCl1·34×10-5mol,质量为1.92×10-3g。
所以,AgCl的溶解度为1.92×10-4g。(溶解度是指100g 水中溶解的溶质的最大质量)
(3)沉淀的生成、溶解、转化
①NH4Cl中的FeCl3杂质可以用氨水除掉。
废水中的重金属离子可以用H2S、Na2S除掉。
CuSO4+H2S=CuS↓+H2SO4
②少量Mg(OH)2会溶解在NH4Cl溶液中。
因为NH4Cl溶液水解显酸性,NH4+、H+都和Mg(OH)2溶解出来的OH-结合,促进了Mg(OH)2溶解。
Mg(OH)2+2NH4Cl=MgCl2+2 NH3+2H2O
③锅炉中的CaSO4难溶于水,又难以处理。加Na2CO3浸泡后,转化为CaCO3。然后用稀盐酸洗掉。
MgCl2中的FeCl3杂质可以用Mg(OH)2除掉。
2FeCl3+3Mg(OH)2=2Fe(OH)3+3MgCl2
AgCl能与KI反应生成更难溶的AgI,AgI能与Na2S反应生成更难溶的Ag2S。
溶解小的,可以转化为溶解度更小的。
【练习】
1、写出水溶液中NH4NO3+NaClO+H2O⇌NH3·H2O+HClO+NaNO3的双水解常数表达式 。
2、写出草酸(二元弱酸H2C2O4)的分步电离方程式、 。
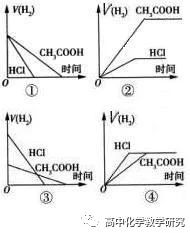
3、等体积等浓度的HCl和CH3COOH中加入过量的Zn时,生成H2的速率与时间的图像为 。生成H2的体积与时间的图像为 。
等体积等H+浓度的HCl和CH3COOH中加入过量的Zn时,生成H2的速率与时间的图像为 。生成H2的体积与时间的图像为 。
4、下列能造成水的电离程度变大的是 ,变小的是 。
①加NaCl②加HCl③加氨水④加Na2CO3⑤加醋酸⑥加NH4Cl
5、常温下,0.003mol/L 的H2SO4的pH值为 。0.0005mol/L 的NaOH的pH值为 。
0.004mol/L 的H2SO4与0.01mol/L 的NaOH等体积混合,pH值为 。
6、强碱滴定弱酸时,选用的指示剂为 。(甲基橙、酚酞)。甲基橙在碱性溶液中的颜色为 。pH试纸测溶液的pH值时的使用方法是 。
7、写出FeCl3的水解方程式。 ;写出Na2CO3的分步水解方程式 。
8、(1)用纯碱洗掉金属表面的油污是利用了。用氯化铵洗掉金属表面的氧化物是利用了 。
(2)配制FeCl3溶液时,易出现浑浊现象,原因是。可以在配制前先加一些盐酸,目的是 。
(3)明矾能做净水剂,原因是 。
9、BaSO4的溶度积为1×10-10,求BaSO4悬浊液中的c(Ba2+)和BaSO4的溶解度。
10、HF(弱酸)溶液中再通入HF气体时,HF的电离程度。NH4Cl溶液中加水稀释时,NH4Cl的水解程度。
NH4Cl溶液中加水稀释时,c(NH4+)/c(OH-)的数值会 ,c(NH3·H2O)/C(NH4+)的数值会 ,c(NH3·H2O)·c(H+)/c(NH4+)的数值会 。
【练习答案】
1、K=c(NH3·H2O)c(HClO)/c(NaClO)c(NH4NO3)或K=c(NH3·H2O)c(HClO)/c(ClO-)c(NH4+)
2、H2C2O4⇌HC2O4-+H+,HC2O4-⇌C2O42-+H+
3、③,④,①,②
4、④⑥,②③⑤
5、3-lg6,10+lg5,11。
6、酚酞,黄,用玻璃棒将溶液点在干燥的pH试纸上,并与标准比色卡对照。
7、FeCl3+3H2O⇌Fe(OH)3+3HCl
Na2CO3+H2O⇌NaHCO3+NaOH,NaHCO3+H2O⇌H2CO3+NaOH
8、(1)纯碱水解显碱性,油脂溶于碱性溶液。氯化铵水解显酸性,金属氧化物与酸性溶液反应。
(2)FeCl3易水解生成Fe(OH)3沉淀。抑制FeCl3水解。
(3)明矾中的Al3+水解能产生胶体粒子,吸附水中的杂质产生沉淀。
9、1×10-10mol/L,2.33×10-4g。
10、变小,变大,变小,变大,不变。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。78 号铂 Pt 、 79 号金 Au 、 80 号汞 Hg 、 82 号铅 Pb 、 92 号铀 U 。 一、铂 78 P...
一、银47Ag 银亲硫,极化能力强。在自然界中常以自然银、硫化物等形式存在,因其离子...
一、镓Ga 从铝土矿Al 2 O 3 或闪锌矿Zns的冶炼过程中提取,最后经电解制得纯净镓。 门...
一、铁 Fe 古代社会铁器时代大约起始于 前 2000 年 ,最早发现和使用的铁是来自外空的...
一、钪Sc 1、单质是柔软、银白色。熔点1500℃以上。钪常用来制特种玻璃、轻质耐高温合...
一、氢 H 1 、 H ,是原子半径最小的元素,有 H (氕)、 D (氘)、 T (氚)等核素...