
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
化学平衡理论是中学化学的重点难点,也是高考的热点,每年必考,且占高考分值较大,但考生往往对此类题目感觉无从下手,不知所措。对于相对抽象和难以理解的化学平衡问题,用常规思路或常规方法不好解决时,不妨对题目中的一些条件、过程等进行假设,然后再结合已学的知识推导并得出结论,就能使复杂的问题简单化,就能使无序的问题模型化,就能轻松自如把题目解决出来,达到事半功倍的效果,常见的假设法有极端假设法、过程假设法、等效假设法。
方法一 极端假设法——不为“0”原则
可逆性是化学平衡的前提,反应达到平衡状态时应是反应物和生成物共存的状态,每种物质的量不为0,即可逆反应“不为0”原则;但在处理化学平衡问题时,特别是在确定某些范围或在范围中选择合适的量时,往往可用极端假设法,即假设反应不可逆,利用完全反应和完全不反应两个极值点求出反应物或生成物的物质的量。虽然这样的极值点是不可能达到的,但却可以帮助我们快速简单的确定某些数值的范围。
[对点练1] 在一密闭容器中进行反应:2SO2(g)+O2(g)  2SO3(g)。已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.2mol·L-1、0.1mol·L-1、0.2mol·L-1。当反应达到平衡时,可能存在的数据是( )
2SO3(g)。已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.2mol·L-1、0.1mol·L-1、0.2mol·L-1。当反应达到平衡时,可能存在的数据是( )
A.SO2为0.4mol·L-1,O2为0.2mol·L-1
B.SO3为0.25mol·L-1
C.SO2、SO3均为0.15mol·L-1
D.SO3为0.4mol·L-1
解析:选B 采取极端假设法,假设SO2和O2全部转化为SO3,此时,SO2和O2的浓度都是0,而c(SO3)=0.4 mol·L-1,再假设SO3全部转化为SO2和O2,此时,SO2和O2的浓度分别是0.4 mol·L-1、0.2 mol·L-1,而c(SO3)=0,故三物质的浓度范围分别为:0<c(SO2)<0.4 mol·L-1,0<c(SO3)<0.4 mol·L-1,0<c(O2)<0.2 mol·L-1,故选项A、D是不可能的;C项数据表明SO2、SO3的浓度都是在原浓度基础上减少了0.05 mol·L-1,这也是不可能的。
[对点练2] 将2.0mol SO2气体和2.0 mol SO3气体混合于固定容积的密闭容器中,在一定条件下发生反应:2SO2(g)+O2(g) 2SO3(g),达到平衡时SO3为nmOL。在相同温度下,分别按下列配比在相同密闭容器中放入起始物质,平衡时SO3等于nmol的是( )
2SO3(g),达到平衡时SO3为nmOL。在相同温度下,分别按下列配比在相同密闭容器中放入起始物质,平衡时SO3等于nmol的是( )
A.1.6mol SO2+0.3 mol O2+0.4mol SO3
B.4.0 mol SO2+1.0 mol O2
C.2.0mol SO2+1.0 mol O2+2.0mol SO3
D.3.0mol SO2+1.0 mol O2+1.0mol SO3
解析:选B 采取极端假设法。将备选项中O2完全转化后(即等效转化),得如下数据:
A.1.0 mol SO2+1.0 mol SO3
B.2.0 mol SO2+2.0 mol SO3
C.4.0 mol SO3
D.1.0 mol SO2+3.0 mol SO3
依据恒温恒容下建立等效平衡的条件,两组量若为等效平衡,进行等效转化后对应量要相等。
方法二 过程假设法——“以退为进”原则
解题时,有时会遇到这样的问题:把一种状态与另一种状态的平衡情况(如转化率、物质的浓度及含量)进行比较,因这一过程较为复杂、抽象而难以得出结论,这就需要采用“以退为进”的策略,将其假设为若干个简单的具体过程,以此为中介进行比较,然后再结合实际条件得出结论。
[对点练3] 把晶体N2O4放入一固定容积的密闭容器中气化并建立N2O4(g) 2NO2(g)平衡后,保持温度不变,再通入与起始时等量的N2O4气体,反应再次达平衡,则新平衡N2O4的转化率与原平衡比( )
2NO2(g)平衡后,保持温度不变,再通入与起始时等量的N2O4气体,反应再次达平衡,则新平衡N2O4的转化率与原平衡比( )
A.变大 B.变小
C.不变 D.无法确定
解析:选B 假设反应过程:
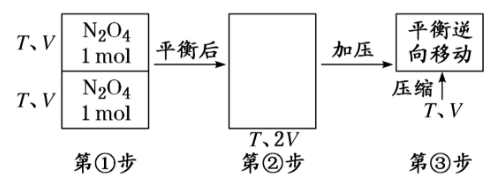
第①步两容器平衡后状态一模一样。
第②步撤去隔板没有任何变化。
第③步压缩时平衡逆向移动,故N2O4的转化率变小,选B。
注意:加入N2O4,该平衡正向移动,这是真实存在的。运用过程假设法,推导平衡逆向移动,逆向移动是虚拟的,不是真实存在的,这一点要特别注意。
[对点练4] 在恒温、恒容密闭容器中发生反应:2SO2(g)+O2(g) 2SO3(g),原有反应物SO2、O2均为1mol,平衡后,再向容器中充入1 mol SO2和1mol O2,则SO2的转化率变化为________(填“增大”“减小”或“不变”)。
2SO3(g),原有反应物SO2、O2均为1mol,平衡后,再向容器中充入1 mol SO2和1mol O2,则SO2的转化率变化为________(填“增大”“减小”或“不变”)。
解析:假设反应过程:
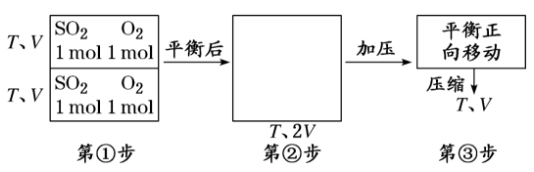
第③步压缩时平衡正向移动,故SO2的转化率增大。
答案:增大
[对点练5] 某温度下,向一体积固定的密闭容器中充入1mol NO2气体,反应2NO2 N2O4达平衡时,测得NO2的转化率为a%,混合气体的总压强为p,维持温度、体积不变,向该容器中继续充入1mol NO2气体,再次达平衡时,测得容器中NO2的转化率为b%,容器内气体总压强为p′,则容器中转化率a%__________(填“>”“<”或“=”)b%;p′________(填“>”“<”或“=”)2p。
N2O4达平衡时,测得NO2的转化率为a%,混合气体的总压强为p,维持温度、体积不变,向该容器中继续充入1mol NO2气体,再次达平衡时,测得容器中NO2的转化率为b%,容器内气体总压强为p′,则容器中转化率a%__________(填“>”“<”或“=”)b%;p′________(填“>”“<”或“=”)2p。
解析:此题可假设过程如下:
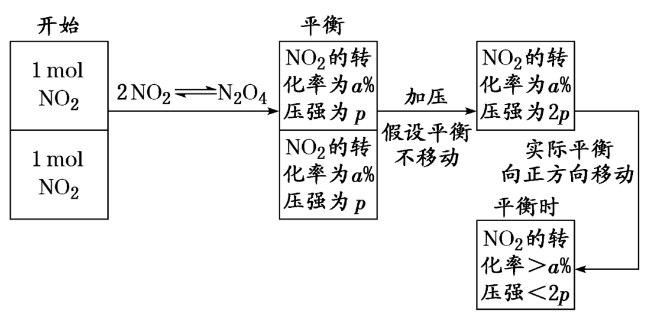
答案:< <
方法三 等效假设法——“一边倒”原则
化学平衡的特征之一是“同”,即条件不变时,无论反应是从正反应开始还是从逆反应开始,或从既有反应物又有生成物的状态开始,均可达到同一平衡状态。等效假设就是通过假设,能够达到与原平衡起始物质的浓度(或物质的量)相等的情况,最终可达到同一平衡状态的方法。处理此类问题时,我们往往有目的的把起始反应物或生成物折算成同一边后再进行分析,也就是“一边倒”原则。
题型(一) 等温等容条件下的等效
(1)反应前后气体分子数不等的可逆反应
对于反应前后气体分子数不等的可逆反应,改变起始时加入物质的物质的量,若按可逆反应化学计量数之比换算成同一半边物质(一边倒),其物质的量对应相等,则它们互为等效平衡。见下表[以可逆反应:2A(g)+B(g) 3C(g)+D(g)为例]:
3C(g)+D(g)为例]:
(2)反应前后气体分子数相等的可逆反应
对于反应前后气体分子数相等的可逆反应,改变起始时加入物质的物质的量,若按可逆反应计量数之比换算成同一半边物质(一边倒),其物质的量对应成比例,则它们互为等效平衡。见下表[以可逆反应:2A(g)+B(g) 3C(g)+D(s)为例]:
3C(g)+D(s)为例]:
[对点练6] 已知2SO2(g)+O2(g) 2SO3(g) ΔH=-197kJ·mol-1。向同温、同体积的三个密闭容器中分别充入气体:(甲)2mol SO2和1 mol O2;(乙)1mol SO2和0.5 mol O2;(丙)2mol SO3。恒温、恒容下反应达平衡时,下列关系一定正确的是( )
2SO3(g) ΔH=-197kJ·mol-1。向同温、同体积的三个密闭容器中分别充入气体:(甲)2mol SO2和1 mol O2;(乙)1mol SO2和0.5 mol O2;(丙)2mol SO3。恒温、恒容下反应达平衡时,下列关系一定正确的是( )
A.容器内压强p:p甲=p丙>2p乙
B.SO3的质量m:m甲=m丙>2m乙
C.c(SO2)与c(O2)之比为k:k甲=k丙>k乙
D.反应放出或吸收热量的数值Q:Q甲=Q丙>2Q乙
解析:选B 根据等效平衡原理,甲容器与丙容器中平衡属于等效平衡,平衡时有p甲=p丙,乙容器与甲容器相比,若两个容器中SO2转化率相同,则p甲=2p乙,但因甲容器中的压强比乙容器中的压强大,故甲容器中的SO2转化率比乙容器中的大,p甲<2p乙,A错。同理分析知B对。甲、乙两容器中,SO2、O2起始的物质的量之比与反应中消耗的物质的量之比均为2∶1,故平衡时两容器中c(SO2)与c(O2)之比相同,C错。由等效平衡原理知,Q甲与Q丙不一定相等,D错。
[对点练7] 一定温度下,在三个体积均为1.0 L的恒容密闭容器中发生反应:2CH3OH(g) CH3OCH3(g)+H2O(g)。
CH3OCH3(g)+H2O(g)。
下列说法正确的是( )
A.该反应的正反应为吸热反应
B.达到平衡时,容器Ⅰ中的CH3OH体积分数比容器Ⅱ中的小
C.容器Ⅰ中反应到达平衡所需时间比容器Ⅲ中的长
D.若起始时向容器Ⅰ中充入CH3OH0.15 mol、CH3OCH30.15 mol和H2O0.10 mol,则反应将向正反应方向进行
解析:选D 由题给表格中的Ⅰ、Ⅲ可知:温度越低,生成物的量越多,说明升高温度平衡逆向移动,则此反应的正反应为放热反应,A选项错误;这是一个反应前后气体分子数不变的反应,达到平衡后,容器Ⅰ和Ⅱ中甲醇的体积分子数相同,B选项错误;容器Ⅰ中温度高,反应速率快,达到平衡所需的时间短,C选项错误;根据387 ℃时,K=4,Q<K,故反应向正反应方向进行,D选项正确。
题型(二) 等温等压下的等效
在等温等压条件下,对于任何有气体物质参加的可逆反应,改变起始时加入物质的物质的量,若按可逆反应化学计量数之比换算成同一半边物质(一边倒),其物质的量对应成比例,则它们互为等效平衡。见下表[以可逆反应:2A(g)+B(g) 3C(g)+D(g)为例]:
3C(g)+D(g)为例]:
[对点练8] 恒温恒压下,在一个容积可变的密闭容器中发生反应:A(g)+B(g) C(g),若开始时通入1mol A和1 mol B,达到平衡时生成amol C。则下列说法错误的是( )
C(g),若开始时通入1mol A和1 mol B,达到平衡时生成amol C。则下列说法错误的是( )
A.若开始时通入3mol A和3 mol B,达到平衡时,生成的C的物质的量为3a mol
B.若开始时通入4mol A、4 mol B和2mol C,达到平衡时,B的物质的量一定大于4mol
C.若开始时通入2mol A、2 mol B和1mol C,达到平衡时,再通入3 mol C,则再次达到平衡后,C的物质的量分数为a/(2-a)
D.若在原平衡体系中,再通入1mol A和1 mol B,混合气体的平均相对分子质量不变
解析:选B 选项A,开始时通入3 mol A和3 mol B,由于容器体积膨胀,保持恒压,相当于将三个原容器叠加,各物质的含量与原平衡中的相同,C的物质的量为3a mol;选项B,无法确定平衡移动的方向,不能确定平衡时B的物质的量一定大于4 mol;选项C,根据题给数据可算出达到平衡时C的物质的量分数为;选项D,这种条件下混合气体的平均相对分子质量不变。
[对点练9] 如图所示,隔板Ⅰ固定不动,活塞Ⅱ可自由移动,M、N两个容器中均发生反应:X(g)+3Y(g) 2Z(g) ΔH=-192kJ·mol-1。向M、N中都通入amol X和bmol Y的混合气体,初始时M、N两容器的容积相同,保持两容器的温度相同且恒定不变。下列说法一定正确的是( )
2Z(g) ΔH=-192kJ·mol-1。向M、N中都通入amol X和bmol Y的混合气体,初始时M、N两容器的容积相同,保持两容器的温度相同且恒定不变。下列说法一定正确的是( )
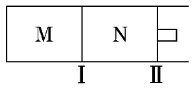
A.平衡时,X的体积分数:M<N
B.若向N中再充入amol X和bmol Y,则平衡时,X的转化率:M>N
C.若a∶b=1∶3,当M中放出172.8kJ热量时,X的转化率为90%
D.若a=1.2,b=1,并且N中达到平衡时体积为2 L,此时含有0.4mol Z,则再通入0.36 mol X时,v(正)<v(逆)
解析:选DA项,反应过程中N中压强大于M中压强,增大压强,平衡向正反应方向移动,故平衡时,X的体积分数:M>N,X的转化率:M<N;B项,向N中再充入a mol X和b mol Y后达到平衡时的状态与未充入X、Y前互为等效平衡,故X的转化率:M<N;C项,反应初始时X的物质的量未知,故转化率未知;D项,反应温度不变,故变化前后平衡常数不变,未再通入X前,
由 X(g) + 3Y(g) ⇌ 2Z(g)
起始/mol 1.2 1
转化/mol 0.2 0.6 0.4
平衡/mol 1 0.4 0.4
计算出平衡时气体总物质的量为1.8 mol,
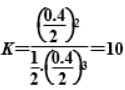 ,
,
通入0.36 mol X后,由体积比与物质的量比成正比可知:
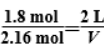 ,
,
解得通入X后的体积V=2.4 L,根据浓度商表达式代入数据可求出,通入X后的浓度商为:

故反应向逆反应方向进行。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。...
一、公式提出的背景 19世纪末,化学家们逐渐意识到温度对化学反应速率具有显著影响,...
假设对于反应 a A(g) + b B(g) g G(g) + h H(g) 中各物质均为理想气体,那么则有平衡...
例:某温度、起始压强为100 kPa下,若将2mol SO 2 和1molO 2 ,通入恒容密闭容器中,...
...
什么是活化能、能垒? 1 、能垒 活化分子含有的能参加化学反应的最低限度的能量,称为...